ผู้เชี่ยวชาญทางการแพทย์ของบทความ
สิ่งตีพิมพ์ใหม่
ภาวะแคระแกร็นจากต่อมใต้สมอง
ตรวจสอบล่าสุด: 12.07.2025

เนื้อหา iLive ทั้งหมดได้รับการตรวจสอบทางการแพทย์หรือตรวจสอบข้อเท็จจริงเพื่อให้แน่ใจว่ามีความถูกต้องตามจริงมากที่สุดเท่าที่จะเป็นไปได้
เรามีแนวทางการจัดหาที่เข้มงวดและมีการเชื่อมโยงไปยังเว็บไซต์สื่อที่มีชื่อเสียงสถาบันการวิจัยทางวิชาการและเมื่อใดก็ตามที่เป็นไปได้ โปรดทราบว่าตัวเลขในวงเล็บ ([1], [2], ฯลฯ ) เป็นลิงก์ที่คลิกได้เพื่อการศึกษาเหล่านี้
หากคุณรู้สึกว่าเนื้อหาใด ๆ ของเราไม่ถูกต้องล้าสมัยหรือมีข้อสงสัยอื่น ๆ โปรดเลือกแล้วกด Ctrl + Enter
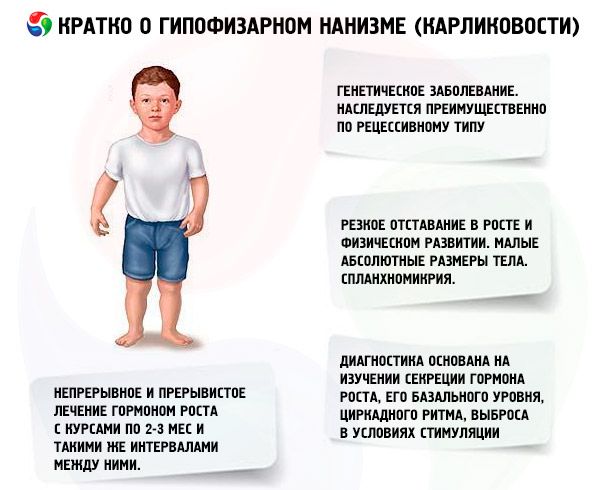
คำว่า "ภาวะแคระแกร็นของต่อมใต้สมอง" (จากภาษากรีก nanos ซึ่งแปลว่า คนแคระ; คำพ้องความหมาย: ภาวะแคระแกร็น, nanosomia, microsomia) ในความหมายที่แท้จริงหมายถึงโรคที่มีอาการหลักคือการเจริญเติบโตที่ช้าลงอย่างรวดเร็ว ซึ่งเกี่ยวข้องกับการที่ต่อมใต้สมองส่วนหน้าหลั่งฮอร์โมนการเจริญเติบโตไม่เพียงพอ
ในความหมายที่กว้างขึ้น ภาวะแคระแกร็นเป็นความผิดปกติของการเจริญเติบโตและพัฒนาการทางกายภาพ ซึ่งการเกิดขึ้นอาจเกิดได้ไม่เพียงแต่จากการขาดฮอร์โมนโซมาโทโทรปิกโดยสิ้นเชิงหรือสัมพันธ์กันอันเนื่องมาจากพยาธิสภาพของต่อมใต้สมองเท่านั้น แต่ยังอาจเกิดจากความผิดปกติของการควบคุมการทำงานของไฮโปทาลามัส (สมอง) ข้อบกพร่องในการสังเคราะห์ฮอร์โมนโซมาโทโทรปิก และความผิดปกติของความไวของเนื้อเยื่อต่อฮอร์โมนนี้ด้วย
สาเหตุ ภาวะแคระแกร็น
ภาวะแคระแกร็นของต่อมใต้สมองส่วนใหญ่เกิดจากโรคทางพันธุกรรม โรคที่พบบ่อยที่สุดคือภาวะแคระแกร็นจากต่อมใต้สมองส่วนหน้า (panhypopituitary dwarfism) ซึ่งถ่ายทอดทางพันธุกรรมในลักษณะด้อย สันนิษฐานว่ามีการถ่ายทอดพยาธิสภาพนี้ 2 ประเภท คือ ถ่ายทอดทางออโตโซมและถ่ายทอดทางโครโมโซม X ภาวะแคระแกร็นประเภทนี้มักเกิดร่วมกับความผิดปกติของการหลั่งฮอร์โมนโซมาโทโทรปิก การหลั่งโกนาโดโทรปินและฮอร์โมนกระตุ้นต่อมไทรอยด์ ซึ่งมักถูกขัดขวาง การหลั่ง ACTH จะถูกขัดขวางน้อยลงและในระดับที่น้อยกว่า การศึกษาการทำงานด้วยฮอร์โมนปลดปล่อย เช่น ฮอร์โมนปลดปล่อยโซมาโทโทรปินสังเคราะห์ (ประกอบด้วยกรดอะมิโน 29, 40 และ 44 ตัว) ซึ่งคล้ายกับโพลีเปปไทด์ของตับอ่อน แสดงให้เห็นว่าผู้ป่วยส่วนใหญ่มีพยาธิสภาพที่ระดับไฮโปทาลามัส และต่อมใต้สมองส่วนหน้าทำงานไม่เพียงพอเป็นผลรอง พยาธิวิทยาขั้นต้นของต่อมใต้สมองนั้นพบได้น้อย
ภาวะแคระแกร็นทางพันธุกรรมที่เกิดจากการขาดฮอร์โมนการเจริญเติบโตเพียงอย่างเดียว ส่งผลให้กิจกรรมทางชีวภาพลดลงและไวต่อฮอร์โมนนี้ พบได้เป็นครั้งคราวในรัสเซียและประเทศเพื่อนบ้าน โดยพบได้บ่อยในทวีปอเมริกา ประเทศในตะวันออกกลางและแอฟริกา จากผลการศึกษาปริมาณฮอร์โมนโซมาโทโทรปิกในเลือดและความไวของผู้ป่วยต่อฮอร์โมนโซมาโทโทรปิกจากภายนอก ระดับอินซูลินที่ตอบสนองต่อภูมิคุ้มกัน (IRI) อินซูลินไลค์โกรทแฟกเตอร์ (IGF) ชนิดที่ 1 (โซมาโตมีดิน ซี) และชนิดที่ 2 และการตอบสนองของ IGF-1 ต่อการรักษาด้วยการเตรียมฮอร์โมนโซมาโทโทรปิก พบว่าภาวะแคระแกร็นประเภทต่างๆ ที่คล้ายคลึงกันทางคลินิกได้รับการระบุ
เมื่อไม่นานมานี้ ได้มีการถอดรหัสพยาธิสภาพของโรคแคระ Laron ซึ่งเกิดจากการขาด IRF-1 และ IRF-II รวมไปถึงพยาธิสภาพของโรคแคระในคนแคระแอฟริกัน ซึ่งมีความเกี่ยวข้องกับการขาด IRF-1 อีกด้วย
ในปีพ.ศ. 2527 ได้มีการบรรยายถึงภาวะแคระแกร็นจากต่อมใต้สมองเทียมรูปแบบใหม่ที่มีระดับฮอร์โมนโซมาโทโทรปิกและ IGF-1 สูง การเกิดภาวะแคระแกร็นเกิดจากข้อบกพร่องในตัวรับ ซึ่งได้รับการพิสูจน์จากการลดลงอย่างรวดเร็วของการจับกันของไฟโบรบลาสต์ของผิวหนังกับ IGF-1
ควรเน้นย้ำว่าในสภาวะปัจจุบันที่มีครอบครัวเล็ก ๆ เกิดขึ้น ผู้ป่วยโรคนี้จำนวนมากที่แยกตัวออกมา (“ไม่ทราบสาเหตุ” เกิดขึ้นโดยบังเอิญ) อาจเป็นโรคทางกรรมพันธุ์ได้เช่นกัน
จากการวิเคราะห์ประวัติผู้ป่วย 350 ราย พบว่าสาเหตุของภาวะแคระแกร็นไม่ชัดเจนในผู้ป่วย 228 ราย (65.2%) กลุ่มนี้รวมถึงผู้ป่วยจาก 57 ครอบครัวที่มีภาวะแคระแกร็นซ้ำแล้วซ้ำเล่า (ครอบครัวละ 2-4 ราย) ซึ่งคิดเป็นร้อยละ 28 ของผู้ป่วยทั้งหมด ในครอบครัวที่มีภาวะแคระแกร็น 77% ที่ไม่สามารถระบุสาเหตุได้ (ส่วนใหญ่เป็นทางพันธุกรรม) พบว่ามีการเชื่อมโยงอย่างไม่อาจปฏิเสธได้กับการถ่ายทอดทางพันธุกรรมของการไม่มีปัจจัย Rh การกระจายของปัจจัย Rh ในครอบครัวของผู้ป่วยภาวะแคระแกร็นแตกต่างจากที่พบในความขัดแย้งของปัจจัย Rh ระหว่างแม่และทารกในครรภ์ และโดยทั่วไปแล้ว จะไม่มีโรคเม็ดเลือดแดงแตกของทารกแรกเกิดร่วมด้วย (พ่ออาจเป็น Rh ลบ และในกรณีที่พ่อแม่มีเฮเทอโรไซโกตของปัจจัย Rh ก็คือลูก เป็นต้น) อาจสันนิษฐานถึงความเชื่อมโยงระหว่างกิจกรรมของยีนที่รับผิดชอบในการสังเคราะห์ฮอร์โมนโซมาโตโทรปิก (หรือฮอร์โมนที่ปลดปล่อยโซมาโตโทรปิน) กับยีนที่กำหนดปัจจัย Rh โดยเฉพาะอย่างยิ่งเนื่องจากภาวะแคระแกร็นส่วนใหญ่และการไม่มีปัจจัย Rh เป็นลักษณะถ่ายทอดทางพันธุกรรมแบบด้อย สิ่งนี้ไม่สามารถอธิบายความหายากของภาวะแคระแกร็นเมื่อเทียบกับความถี่ของผู้ที่มี Rh ลบในประชากรได้ อาจเป็นไปได้ว่าปัจจัยเพิ่มเติมบางอย่างที่ยังไม่ทราบแน่ชัดมีความสำคัญ แต่ลักษณะการกระจายของปัจจัย Rh ในครอบครัวที่มีผู้ป่วยภาวะแคระแกร็นแบบครอบครัวและแบบไม่สม่ำเสมอไม่น่าจะเกิดขึ้นโดยบังเอิญ
กลุ่มผู้ป่วยภาวะแคระแกร็นจำนวนมาก (สมองหลัก สมอง-ต่อมใต้สมอง) คือผู้ป่วยที่มีพยาธิสภาพทางอินทรีย์ของระบบประสาทส่วนกลางประเภทต่างๆ ที่เกิดขึ้นในครรภ์หรือในวัยเด็ก สาเหตุทางกายวิภาคที่ทำให้เกิดพยาธิสภาพนี้ได้แก่ ต่อมใต้สมองที่พัฒนาไม่เต็มที่หรือไม่มีเลย ต่อมใต้สมองเสื่อมจากการสร้าง sella turcica ต่อมใต้สมองเสื่อมแบบซีสต์ ต่อมใต้สมองฝ่อเนื่องจากถูกกดทับด้วยเนื้องอก (craniopharyngioma, chromophobe adenoma, meningioma, glioma) ภาวะแคระแกร็นอาจเกิดจากการบาดเจ็บที่บริเวณไฮโปทาลามัส-ต่อมใต้สมอง (ในมดลูก คลอด หรือหลังคลอด) ซึ่งมักเกิดขึ้นในหญิงตั้งครรภ์แฝด รวมถึงระหว่างการคลอดบุตรในท่าก้นลง ท่าเท้า หรือท่าขวางที่มีการหมุนขา (ซึ่งเป็นกลไกการคลอดบุตรในผู้ป่วยภาวะแคระแกร็นมากกว่า 1/3 ราย) ความเสียหายจากการติดเชื้อและพิษมีความสำคัญ (การติดเชื้อไวรัสในมดลูก วัณโรคซิฟิลิสมาเลเรีย โรคทอกโซพลาสโมซิส โรคที่เกิดขึ้นในช่วงอายุน้อย ภาวะติดเชื้อในทารกแรกเกิด เยื่อหุ้มสมองอักเสบและเยื่อหุ้มสมองอักเสบ เป็นต้น) กระบวนการเหล่านี้อาจทำลายต่อมใต้สมอง ศูนย์กลางไฮโปทาลามัสที่ควบคุมการทำงานของต่อม และขัดขวางการเชื่อมต่อการทำงานปกติในระบบประสาทส่วนกลาง
การบาดเจ็บของทารกในครรภ์สามารถนำไปสู่การเกิดของผู้ป่วยที่ “แคระแกร็นตั้งแต่เกิด” ที่มีการหลั่งฮอร์โมนการเจริญเติบโตปกติ (แคระแกร็นในสมองแต่กำเนิด ศีรษะเล็ก แคระแกร็นแบบซิลเวอร์รัสเซลล์พร้อมกับรูปร่างไม่สมมาตรและมีระดับฮอร์โมนโกนาโดโทรปินสูง เป็นต้น)
ปัจจัยเพิ่มเติมที่ทำให้การละเมิดพัฒนาการทางกายภาพในภาวะแคระแกร็นรุนแรงขึ้นอาจเกิดจากโภชนาการที่ไม่เพียงพอ ไม่สมดุลในแง่ของส่วนประกอบที่จำเป็น (ขาดโปรตีน) และธาตุอาหารรอง (ขาดสังกะสี) และสภาพแวดล้อมที่ไม่เอื้ออำนวย ตลอดจนโรคเรื้อรังต่างๆ เช่น โรคไตอักเสบ ซึ่งภาวะอะโซเทเมียส่งผลต่อการทำงานของตัวรับในตับ หรือส่งผลโดยตรงต่อการเผาผลาญของเซลล์ตับ ทำให้การสังเคราะห์โซมาโตมีดินลดลง หรือตับแข็งเมื่อการสร้างโซมาโตมีดินบกพร่อง
กลไกการเกิดโรค
ในผู้ป่วยส่วนใหญ่ที่มีภาวะแคระแกร็นของต่อมใต้สมอง การเปลี่ยนแปลงจะไม่จำกัดอยู่เพียงพยาธิสภาพของการหลั่งฮอร์โมนโซมาโทโทรปิกและความไวต่อฮอร์โมนดังกล่าวเท่านั้น แต่ยังขยายไปถึงฮอร์โมนโทรปิกอื่น ๆ ของต่อมใต้สมอง ซึ่งทำให้เกิดความผิดปกติในระบบต่อมไร้ท่อและการเผาผลาญในรูปแบบต่าง ๆ ร่วมกัน
ในกรณีขาดฮอร์โมนโซมาโทโทรปิกแบบแยกส่วน การเปลี่ยนแปลงทางสัณฐานวิทยาในต่อมใต้สมองได้รับการศึกษาอย่างไม่เพียงพอ ในกรณีศึกษา ความผิดปกติทางพยาธิวิทยาพบได้น้อยมาก (craniopharyngioma หรือ hyperostosis ของกระดูกกะโหลกศีรษะ) ในภาวะแคระแกร็นประเภทนี้ อาจพบเซลล์เปปไทด์ที่พัฒนาไม่เต็มที่แต่กำเนิดหรือข้อบกพร่องในระบบสารสื่อประสาทในไฮโปทาลามัส ในกรณีดังกล่าว ภาวะแคระแกร็นอาจรวมกับภาวะดิสพลาเซียหรือไฮโปพลาเซียของเส้นประสาทตา ซีสต์ภายในเซลล่า เนื้องอกของต่อมใต้สมองและไฮโปทาลามัสทำให้เกิดภาวะขาดฮอร์โมน STH ส่งผลให้เนื้อเยื่อต่อมใต้สมองถูกกดทับ โดยเฉพาะโซมาโทโทรปิก
ภาวะแคระแกร็นมีลักษณะเฉพาะคือกระดูกบางลง ซึ่งส่วนใหญ่เกิดจากชั้นคอร์เทกซ์ การแบ่งตัวและการสร้างกระดูกที่ล่าช้าของโครงกระดูก อวัยวะภายในมีสภาพไม่สมบูรณ์ บางครั้งฝ่อลง และกล้ามเนื้อพัฒนาไม่เต็มที่
อาการ ภาวะแคระแกร็น
การเจริญเติบโตและพัฒนาการทางร่างกายที่ล่าช้าเป็นอาการหลักของภาวะแคระแกร็นของต่อมใต้สมอง ผู้ป่วยจะเกิดมามีน้ำหนักและความสูงปกติ และจะเริ่มมีการเจริญเติบโตล่าช้าตั้งแต่อายุ 2-4 ปี
ก่อนจะมีการรักษาแบบเชิงรุกสำหรับกลุ่มคนแคระ คนแคระถือเป็นผู้ที่มีความสูงน้อยกว่า 120 ซม. สำหรับผู้หญิงและ 130 ซม. สำหรับผู้ชาย ปัจจุบัน ความสูงของคนแคระจะแตกต่างไปจากค่าเฉลี่ยในตารางอย่างน้อย 2-3 ซิกม่าสำหรับเพศ อายุ หรือประชากรที่กำหนด นอกจากนี้ยังมีวิธีการประเมินความสูงแบบกราฟิกโดยใช้เส้นโค้งการแจกแจงแบบเกาส์เซียน ในกรณีนี้ คนแคระตามความสูงจะรวมอยู่ในกลุ่มที่มีจำนวนบุคคลน้อยที่สุดในประชากรที่เกี่ยวข้องซึ่งมีความล่าช้ามากที่สุดจากค่าเฉลี่ยการเจริญเติบโต
ภาวะแคระแกร็นของต่อมใต้สมองไม่เพียงแต่มีลักษณะเฉพาะคือขนาดร่างกายที่เล็กเท่านั้น แต่ยังมีลักษณะการเจริญเติบโตและพลวัตทางการพัฒนาทางกายภาพในแต่ละปีที่ไม่มากอีกด้วย รูปร่างของร่างกายนั้นไม่สมดุลกัน แต่สัดส่วนของร่างกายของผู้ป่วยนั้นมีลักษณะทั่วไปเหมือนในวัยเด็ก ผิวจะซีด มักมีสีเหลืองอมเขียว แห้ง ซึ่งเกิดจากการทำงานของต่อมไทรอยด์ที่ไม่เพียงพอหรือสัมพันธ์กัน บางครั้งอาจมีอาการเขียวคล้ำหรือเป็นลายหินอ่อนบนผิวหนัง ในผู้ป่วยที่ไม่ได้รับการรักษา ผิวหนังที่ดูแก่และมีริ้วรอย (geroderma) จะปรากฏขึ้นเร็ว ซึ่งเกิดจากการทำงานของต่อมไทรอยด์ที่ไม่เพียงพอและการเปลี่ยนแปลงของเซลล์ที่เกิดขึ้นอย่างช้าๆ
ผมบนศีรษะอาจเป็นปกติหรือแห้ง บาง เปราะ ขนตายาวเป็นเรื่องปกติ มักไม่มีการเจริญเติบโตของเส้นผมรอง ขนาดของ sella turcica ในผู้ป่วยส่วนใหญ่ที่เป็นโรคแคระแกร็น (70-75%) ไม่เปลี่ยนแปลง แต่ sella มักจะยังคงมีรูปร่างเหมือนเด็กของ "รูปวงรียืน" มีหลังกว้าง "แบบเด็ก" ไซนัสของกระดูกสฟีนอยด์ล้าหลังในแง่ของการเติมอากาศ อย่างไรก็ตาม มีผู้ป่วยบางรายที่มี sella turcica โต ซึ่งเป็นสัญญาณของเนื้องอก มีบริเวณที่มีการสะสมแคลเซียมบนพื้นหลังหรือบริเวณทางเข้า (มี craniopharyngioma ผลตกค้างของการติดเชื้อในระบบประสาท) หรือลดลง (สัญญาณของการพัฒนาที่ไม่เพียงพอ ต่อมใต้สมองมีขนาดเล็ก) อาการของความดันโลหิตสูงในกะโหลกศีรษะ ได้แก่ กระดูกกะโหลกศีรษะบางลง หลอดเลือดขยายตัว มีรอยประทับของนิ้ว เป็นต้น สัญญาณที่สำคัญที่สุดของภาวะแคระแกร็นจากต่อมใต้สมองคือ ความล่าช้าในการแบ่งตัวและการสร้างกระดูกของโครงกระดูก ลักษณะของระบบฟันยังเกี่ยวข้องอย่างใกล้ชิดกับการแบ่งตัวของโครงกระดูกด้วย สังเกตเห็นการเปลี่ยนฟันน้ำนมช้า ความล่าช้าในการพัฒนาโครงกระดูกพบมากที่สุดในผู้ป่วยที่มีภาวะแคระแกร็น มีปัญหาทางเพศและภาวะไทรอยด์ทำงานน้อย
อวัยวะเพศของผู้ป่วยส่วนใหญ่มีพัฒนาการช้ามาก แม้ว่าความผิดปกติจะพบได้น้อย เราพบภาวะอัณฑะไม่ลงถุงในผู้ชาย 5.8% ภาวะเสื่อมสมรรถภาพทางเพศมาพร้อมกับลักษณะทางเพศรองที่พัฒนาไม่เต็มที่และความต้องการทางเพศลดลง ขาดประจำเดือน การพัฒนาทางเพศตามธรรมชาติปกติพบได้เฉพาะในผู้ป่วยที่มีภาวะขาดฮอร์โมนการเจริญเติบโตและในผู้ป่วยบางรายที่มีภาวะแคระแกร็นในสมอง
ภาวะไทรอยด์ทำงานไม่เพียงพอเป็นอาการทั่วไปของภาวะแคระแกร็น ควรสังเกตว่าอาการภายนอกของภาวะไทรอยด์ทำงานน้อยไม่ได้สะท้อนถึงสถานะการทำงานที่แท้จริงของต่อมไทรอยด์เสมอไป สาเหตุเกิดจากภาวะไทรอยด์ทำงานน้อยเนื่องจากการเปลี่ยนแปลงของไทรอกซิน (T4 )ไปเป็นไทรไอโอโดไทรโอนีน (T3 ) ผิดปกติ และเกิดการสร้างT3ที่ไม่ทำงาน (กลับคืนได้) ซึ่งเป็นลักษณะเฉพาะของภาวะไทรอยด์ทำงานน้อย
การทำงานของต่อมหมวกไตในภาวะแคระแกร็นของต่อมใต้สมองจะลดลงน้อยลงและในระดับน้อยกว่าการทำงานของเพศและการกระตุ้นต่อมไทรอยด์ และในผู้ป่วยส่วนใหญ่ ไม่จำเป็นต้องได้รับการแก้ไขเป็นพิเศษ
ในกรณีส่วนใหญ่ สติปัญญาไม่ได้บกพร่อง แต่พบการเปลี่ยนแปลงทางอารมณ์ในรูปแบบของภาวะจิตใจไม่ปกติ ในผู้ป่วยสูงอายุที่ไม่มีความบกพร่องทางสติปัญญา อาจพบอาการทางประสาทที่ตอบสนองต่อสิ่งเร้าได้
ในโรคสมองออร์แกนิก โดยเฉพาะอย่างยิ่งที่มีลักษณะเป็นเนื้องอก ภาวะแคระแกร็นอาจเกิดขึ้นได้โดยมีอาการของโรคเบาหวานจืด อาการตาบอดครึ่งซีก และความบกพร่องทางสติปัญญา
การศึกษาพัฒนาการของกิจกรรมไฟฟ้าชีวภาพของสมองในผู้ป่วยที่ไม่มีอาการทางอินทรีย์ของระบบประสาทส่วนกลางแสดงให้เห็นว่า EEG มีลักษณะเฉพาะคือยังไม่บรรลุนิติภาวะ รักษาแรงดันไฟฟ้า EEG "แบบเด็ก" สูงในระยะยาว จังหวะอัลฟาไม่สม่ำเสมอในด้านแอมพลิจูดและความถี่ เนื้อหาจังหวะ θ และ δ ช้าเพิ่มขึ้นอย่างรวดเร็ว โดยเฉพาะในลีดด้านหน้าและส่วนกลาง ปฏิกิริยาที่ชัดเจนต่อการหายใจเร็ว การเปลี่ยนแปลงในช่วงของจังหวะ EEG ตามจังหวะการกระตุ้นแสงไปสู่ความถี่ต่ำ (หลักฐานของการลดลงของการเคลื่อนไหวทางการทำงานของโครงสร้างประสาทของสมอง) พบว่าในผู้ป่วยสูงอายุ ลักษณะที่ยังไม่บรรลุนิติภาวะของกิจกรรมไฟฟ้าของสมองเกิดจากการพัฒนาทางเพศที่ไม่เพียงพอ และในผู้ป่วยทุกกลุ่มอายุ - ภาวะไทรอยด์ทำงานน้อย
การเผาผลาญคาร์โบไฮเดรตในผู้ป่วยที่เป็นโรคแคระแกร็นนั้นมีลักษณะเฉพาะคือ มีแนวโน้มที่ระดับน้ำตาลในเลือดขณะอดอาหารจะลดลง เพิ่มขึ้นเมื่อออกกำลังกาย มีอินซูลินในร่างกายไม่เพียงพอ มีความไวต่ออินซูลินภายนอกมากขึ้น และเกิดภาวะน้ำตาลในเลือดต่ำบ่อยครั้ง สาเหตุหลักมาจากระดับฮอร์โมนต้านอินซูลินในร่างกายของผู้ป่วยไม่เพียงพอ
อวัยวะภายในแสดงอาการ splanchnomycria กล่าวคือ ขนาดของอวัยวะลดลง ไม่มีรายงานการเปลี่ยนแปลงการทำงานของอวัยวะภายในที่เฉพาะเจาะจงกับภาวะแคระแกร็น มักพบภาวะความดันโลหิตต่ำในหลอดเลือดแดง โดยความดันซิสโตลิกและไดแอสโตลิกลดลง และแอมพลิจูดของชีพจรลดลง เสียงหัวใจจะเบาลง ได้ยินเสียงพึมพำเกี่ยวกับการทำงานต่างๆ เนื่องมาจากการเปลี่ยนแปลงของสารอาหารในกล้ามเนื้อหัวใจและความผิดปกติของระบบประสาทอัตโนมัติ คลื่นไฟฟ้าหัวใจมีลักษณะเฉพาะคือ แรงดันต่ำ (โดยเฉพาะในกรณีที่มีภาวะไทรอยด์ทำงานน้อย) หัวใจเต้นช้าแบบไซนัสหรือหัวใจเต้นช้า PCG แสดงให้เห็นแอมพลิจูดของโทนเสียงที่ลดลง โทนเสียงเพิ่มเติม และเสียงพึมพำเกี่ยวกับการทำงาน ข้อมูลออกซิเจนในเลือดบ่งชี้ถึงภาวะขาดออกซิเจน (ในช่วงแรกและระหว่างออกแรงกาย) และภาวะขาดออกซิเจน ผู้ป่วยสูงอายุบางครั้งอาจเกิดความดันโลหิตสูง
การวินิจฉัย ภาวะแคระแกร็น
การวินิจฉัยและการวินิจฉัยแยกโรคแคระแกร็นนั้นอาศัยข้อมูลประวัติทางการแพทย์และการตรวจทางคลินิก รังสีวิทยา ห้องปฏิบัติการ และฮอร์โมนอย่างครอบคลุม นอกจากขนาดร่างกายโดยรวมแล้ว เพื่อประเมินการเจริญเติบโตของผู้ป่วยแล้ว ยังต้องกำหนดการขาดดุลการเจริญเติบโตด้วย ซึ่งได้แก่ ความแตกต่างระหว่างส่วนสูงของผู้ป่วยกับค่าเฉลี่ยของเพศและอายุที่สอดคล้องกัน อายุการเจริญเติบโต ได้แก่ การปฏิบัติตามส่วนสูงของผู้ป่วยตามมาตรฐานบางประการ ตัวบ่งชี้ความเบี่ยงเบนที่เป็นมาตรฐาน
I = M - Mcp / δ โดยที่ M คือส่วนสูงของผู้ป่วย Mcp คือส่วนสูงปกติโดยเฉลี่ยสำหรับเพศและอายุที่กำหนด δ คือค่าเบี่ยงเบนกำลังสองจาก Mcp I น้อยกว่า 3 ถือเป็นลักษณะทั่วไปของภาวะผอมบาง I มากกว่า 3 ถือเป็นลักษณะทั่วไปของภาวะอ้วนใหญ่ ตัวบ่งชี้นี้สามารถนำมาใช้ในการประเมินพลวัตของการพัฒนา
การตรวจเอกซเรย์ของผู้ป่วยที่มีภาวะแคระแกร็นเผยให้เห็นสัญญาณของความดันในกะโหลกศีรษะสูง ผลตกค้างจากการติดเชื้อในระบบประสาท การสร้างแคลเซียม และการปิดกะโหลกศีรษะ การศึกษาขนาด รูปร่าง และโครงสร้างของ sella turcica ถือเป็นตัวบ่งชี้ทางอ้อมที่บ่งบอกถึงขนาดของต่อมใต้สมอง อาการที่สำคัญที่สุดอย่างหนึ่งของการเจริญเติบโตช้าทางพยาธิวิทยาคือความผิดปกติของการแยกส่วนของโครงกระดูก เพื่อประเมินระดับความสมบูรณ์ของโครงกระดูก จะต้องกำหนดอายุของกระดูก (จากภาพรังสี) ซึ่งสอดคล้องกับการแยกส่วนของเนื้อเยื่อกระดูก ความบกพร่องของการสร้างกระดูกคือระดับของความล่าช้าของการสร้างกระดูกจากค่าปกติ (เป็นปี) ค่าสัมประสิทธิ์การสร้างกระดูกคือผลหารของอายุของกระดูกตามระยะเวลาและพารามิเตอร์อื่นๆ
การวินิจฉัยภาวะแคระแกร็นในปัจจุบันนั้นเป็นไปไม่ได้เลยหากไม่ได้ศึกษาการหลั่งของฮอร์โมนโซมาโตโทรปิก ระดับพื้นฐานของฮอร์โมน จังหวะชีวภาพ และการหลั่งฮอร์โมนภายใต้การกระตุ้น ผู้ป่วยส่วนใหญ่ที่มีภาวะแคระแกร็นจากต่อมใต้สมองมีลักษณะเฉพาะคือมีปริมาณฮอร์โมนโซมาโตโทรปิกในซีรั่มเลือดลดลง เมื่อพิจารณาจากวิธีการตรวจภูมิคุ้มกันด้วยรังสี จะพบว่า (ตามข้อมูลของผู้เขียนหลายราย) มีตั้งแต่ (0.87±0.09) ถึง (1.50±0.64) นาโนกรัม/มล. โดยมีค่าปกติเฉลี่ยอยู่ที่ (3.81±0.29) นาโนกรัม/มล. การศึกษาจังหวะชีวภาพของ การ หลั่งฮอร์โมนโซมาโตโทรปิกในแต่ละวันพบว่าระดับฮอร์โมนดังกล่าวในผู้ที่มีสุขภาพดีจะสูงสุดในช่วง 2 ชั่วโมงแรกของการนอนหลับและช่วง 04.00-06.00 น. ในภาวะแคระแกร็น ปริมาณฮอร์โมนโซมาโตโทรปิกจะลดลงในช่วงเวลาดังกล่าวเช่นกัน
ในการศึกษาปริมาณสำรองของฟังก์ชันโซมาโตโทรปิก จะใช้สารกระตุ้นต่างๆ โดยตรวจสอบเนื้อหาของฮอร์โมนโซมาโตโทรปิกก่อนและหลังการนำมาใช้ โดยเจาะเลือดเพื่อศึกษาทุกๆ 30 นาทีเป็นเวลา 2-3 ชั่วโมง การปลดปล่อยฮอร์โมนโซมาโตโทรปิกหลังการกระตุ้นถือว่าปกติอย่างน้อย 7-10 นาโนกรัม/มิลลิลิตร บางครั้งอาจถึง 20-40 นาโนกรัม/มิลลิลิตร หากไม่มีปฏิกิริยาในตัวอย่างใดตัวอย่างหนึ่ง ให้ทำการทดสอบซ้ำด้วยสารกระตุ้นอื่นๆ ถือว่ามีฮอร์โมนโซมาโตโทรปิกไม่เพียงพอในกรณีที่ไม่มีการปล่อยฮอร์โมนโซมาโตโทรปิกในตัวอย่างที่แตกต่างกัน 2-3 ตัวอย่าง
การทดสอบกระตุ้นที่ใช้กันทั่วไป ได้แก่ การให้อินซูลินทางเส้นเลือดดำ 0.1 หน่วย (0.75-1.5 หน่วย) ต่อน้ำหนักตัวผู้ป่วย 1 กิโลกรัม และเกิดภาวะน้ำตาลในเลือดต่ำ (ระดับน้ำตาลในเลือดลดลง 50% เมื่อเทียบกับระดับเริ่มต้น) ฮอร์โมนโซมาโทโทรปิกในซีรั่มจะถูกกำหนดตามรูปแบบข้างต้น หากเกิดภาวะน้ำตาลในเลือดต่ำอย่างรุนแรง การทดสอบจะถูกหยุดลง และให้กลูโคสทางเส้นเลือดแก่ผู้ป่วย นี่เป็นวิธีการวินิจฉัยแบบคลาสสิกที่พบบ่อยที่สุด
TRH ในขนาด 200-500 mcg ฉีดเข้าเส้นเลือด ระบุปริมาณฮอร์โมนสำรองได้อย่างมีประสิทธิภาพ ไม่ก่อให้เกิดภาวะแทรกซ้อน เมื่อใช้ร่วมกับการทดสอบอินซูลิน จะทำให้สามารถประเมินระดับความเสียหายของระบบไฮโปทาลามัส-ต่อมใต้สมองได้ ปฏิกิริยาเชิงบวกต่อ TRH ในกรณีที่ไม่มีอินซูลินแสดงว่าต่อมใต้สมองยังทำงานได้ปกติ และเกิดความเสียหายที่ระดับไฮโปทาลามัส ปฏิกิริยาเชิงลบต่อ TRH และภาวะน้ำตาลในเลือดต่ำแสดงว่าต่อมใต้สมองเสียหาย
TRH, LH-RH ในขนาดยา 300 mcg ฉีดเข้าเส้นเลือดดำนั้นเหมือนกับตัวก่อนหน้านี้
Human SGH เป็นสารประกอบสังเคราะห์ที่มีฤทธิ์ทางชีวภาพที่แยกได้จากเนื้องอกของตับอ่อน ปัจจุบันมี SGH สังเคราะห์ 3 ชนิด ได้แก่ กรดอะมิโน 29, 40 และ 44 ชนิด ฉีดเข้าเส้นเลือดดำในปริมาณ 1 ถึง 3 ไมโครกรัมต่อน้ำหนักตัวผู้ป่วย 1 กิโลกรัม การปล่อย STH จะเกิดขึ้นภายใน 15-20 นาทีหลังการให้ยา การทดสอบนี้มีประสิทธิภาพมากกว่าวิธีอื่นในการเปิดเผยปริมาณสำรองของฮอร์โมนการเจริญเติบโตภายในร่างกาย ปฏิกิริยา SGH ที่เป็นบวกบ่งชี้ถึงความเสียหายในระดับไฮโปทาลามัสต่อการทำงานของโซมาโทโทรปิกและต่อมใต้สมองที่ยังคงสมบูรณ์ โดยให้กรดอะมิโน (แอล-อาร์จินีนโมโนคลอไรด์ ออร์นิทีน ทริปโตเฟน ไกลซีน ลิวซีน) ฉีดเข้าเส้นเลือดดำในปริมาณ 0.25-0.5 กรัมต่อน้ำหนักตัวผู้ป่วย 1 กิโลกรัม มีประสิทธิภาพในการศึกษาปริมาณสำรองของ SGH อาจทำให้เกิดอาการแพ้ได้
แอล-โดปา รับประทานในขนาด 250-500 ไมโครกรัม มีประสิทธิภาพ ผู้ป่วยยอมรับได้ดี
การทดสอบด้วยกลูคากอน โบรมีนเออร์โกคริปทีน (พาร์โลเดล) ไลซีนวาโซเพรสซิน โคลนิดีน และการโหลดเออร์โกเมตริกแบบจักรยานตามขนาดยาก็ใช้ด้วยเช่นกัน
การศึกษาสถานะของการทำงานของฮอร์โมนการเจริญเติบโตมีความจำเป็นไม่เพียงแต่สำหรับการวินิจฉัยภาวะแคระแกร็นเท่านั้น แต่ยังจำเป็นสำหรับการเลือกวิธีการรักษาที่เหมาะสมด้วย เนื่องจากการรักษาด้วยฮอร์โมนการเจริญเติบโตนั้นสมเหตุสมผลเฉพาะในกรณีที่มีฮอร์โมนการเจริญเติบโตในร่างกายไม่เพียงพอเท่านั้น
สำหรับการวินิจฉัยภาวะแคระแกร็นนั้น การศึกษาเนื้อหาของปัจจัยการเจริญเติบโตคล้ายอินซูลินหรือโซมาโตมีดิน (โดยเฉพาะ IGF-1 หรือโซมาโตมีดิน C) ซึ่งเป็นตัวกลางของการทำงานของฮอร์โมนโซมาโตโทรปิกในระดับเนื้อเยื่อนั้นมีความสำคัญมาก เป็นที่ทราบกันดีว่าเนื้อหาของโซมาโตมีดิน C ในภาวะแคระแกร็นจะลดลง และในภาวะอะโครเมกาลี เนื้อหาของโซมาโตมีดิน C จะเพิ่มขึ้นเมื่อเทียบกับปกติ ภาวะแคระแกร็นที่อธิบายโดย Laron เป็นโรคชนิดหนึ่งที่มีการสร้าง STH ตามปกติ แต่มีการละเมิดการสร้าง IGF-1 และ IGF-II การรักษาผู้ป่วยดังกล่าวด้วยโซมาโตโทรปินนั้นไร้ผล
ตัวบ่งชี้ทางอ้อมของหน้าที่ทางโซมาโตทรอปิกของต่อมใต้สมองคือกิจกรรมของฟอสฟาเตสอัลคาไลน์และปริมาณฟอสฟอรัสอนินทรีย์ในซีรั่ม ในสภาวะไฮโปโซมาโตทรอปิก ตัวบ่งชี้เหล่านี้จะลดลง ในรูปแบบแพนไฮโปพิทูอิทารีของภาวะแคระแกร็น การหลั่งของโกนาโดโทรปิน มักจะเป็น TSH จะลดลง ซึ่งมาพร้อมกับการลดลงของหน้าที่ของต่อมเพศ (การขาดแอนโดรเจนหรือเอสโตรเจน) ต่อมไทรอยด์ (ระดับ T3 , T4 ,ไอโอดีนที่จับกับโปรตีน - PBI ลดลง การสะสมของ131 I โดยต่อมไทรอยด์) และต่อมหมวกไต (ปริมาณคอร์ติซอลและ 17-OCS ลดลงในพลาสมา การขับถ่าย 17-KC และ 17-OCS ในปัสสาวะ ภาวะลิมโฟไซต์ลดลง)
ภาวะแคระแกร็นทางพันธุกรรมของต่อมใต้สมอง (hypothalamic-pituitary) ทุกประเภทมีลักษณะเฉพาะคือเด็กในครอบครัวที่เป็นโรคซ้ำๆ กัน โดยถ่ายทอดทางพันธุกรรมแบบ...
ในภาวะแคระแกร็นทางพันธุกรรมที่มีเนื้อเยื่อไม่ไวต่อฮอร์โมนการเจริญเติบโต ภาพทางคลินิกจะคล้ายกับภาวะขาดฮอร์โมนการเจริญเติบโตแบบแยกเดี่ยว แต่การบำบัดด้วยฮอร์โมนการเจริญเติบโตไม่ได้ผล ในกลุ่มนี้ สามารถแยกแยะรูปแบบหลักต่อไปนี้ตามระดับ IRF ได้: ที่มีเนื้อหาปกติ (ข้อบกพร่องของตัวรับ IRF) และลดลง - ภาวะแคระแกร็นแบบ Laron (ภาวะขาด IRF-1 และ IRF-II) และประเภทที่พบในคนแคระแอฟริกัน (ภาวะขาด IRF-1)
ภาวะแคระแกร็นของสมองมีลักษณะเฉพาะคือมีโรคเฉพาะในครอบครัวที่เกี่ยวข้องกับความเสียหายของระบบประสาทส่วนกลางในครรภ์หรือหลังคลอด โดยมีการเปลี่ยนแปลงทางอวัยวะภายในที่ชัดเจนในระบบประสาทส่วนกลาง มักเกิดร่วมกับพยาธิสภาพของอวัยวะการมองเห็น การมีเบาหวานจืด ระบบสืบพันธุ์ยังคงทำงานตามปกติ และสติปัญญาเปลี่ยนแปลงไป
โรคต่อมเพศผิดปกติและโรคเอจเนสบางชนิดมักมาพร้อมกับภาวะเตี้ยอย่างเห็นได้ชัด โดยเฉพาะอย่างยิ่งโรค Shereshevsky-Turner และโรคอัณฑะผิดปกติแบบ "Turneroid" (โมเสก) การศึกษาไซโตเจเนติกส์ (โครมาตินเพศ แคริโอไทป์) ช่วยในการวินิจฉัยแยกโรค เผยให้เห็นข้อบกพร่องของโครโมโซม ตลอดจนข้อบกพร่องที่เป็นลักษณะเฉพาะของการพัฒนาทางร่างกายและทางเพศ ระดับฮอร์โมนโซมาโทโทรปิกในร่างกายปกติหรือสูงขึ้น และความไม่ไวต่อการรักษาด้วยโซมาโทโทรปิน
ในบรรดาความผิดปกติของต่อมไร้ท่อที่เกิดขึ้นกับร่างกายที่เตี้ย ควรแยก ภาวะไทรอยด์ทำงานน้อยแบบปฐม ภูมิ ซึ่งเกิดจากภาวะไทรอยด์ทำงานน้อยแต่กำเนิดหรือภาวะไทรอยด์ทำงานน้อย ความผิดปกติของเอนไซม์ในกระบวนการสังเคราะห์ฮอร์โมนไทรอยด์ ความเสียหายของต่อมไทรอยด์จากภูมิคุ้มกันทำลายตนเองในระยะเริ่มต้น ในภาวะเหล่านี้ อาการของภาวะไทรอยด์ทำงานน้อยโดยมีระดับ TSH สูง ระดับ T4 และ T3 ในซีรั่มในเลือดลดลงจะเด่นชัดในภาวะ ต่อม ไทรอยด์ทำงานน้อยจากภูมิคุ้มกันทำลายตนเอง จะตรวจพบแอนติบอดีต่อไทรอยด์กลอบูลิน ไมโครโซม และเศษส่วนนิวเคลียสของเนื้อเยื่อไทรอยด์ในเลือด ระดับฮอร์โมนโซมาโทโทรปิกจะปกติหรือลดลง ผลทางคลินิกสามารถทำได้โดยชดเชยภาวะไทรอยด์ทำงานน้อยเท่านั้น
รูปร่างเตี้ยมาพร้อมกับพัฒนาการทางเพศก่อนวัยอันควรและกลุ่มอาการต่อมหมวกไตและอวัยวะสืบพันธุ์เนื่องจากเขตการเจริญเติบโตปิดตัวก่อนเวลาอันควร; โรค Itsenko-Cushing ซึ่งเกิดขึ้นในวัยเด็กเนื่องจากฤทธิ์ยับยั้งการหลั่งฮอร์โมนโซมาโทโทรปิกของกลูโคคอร์ติคอยด์และฤทธิ์สลายฮอร์โมน; กลุ่มอาการ Mauriac - รูปร่างเตี้ยและภาวะทารกของผู้ป่วยโรคเบาหวานที่ต้องพึ่งอินซูลินอย่างรุนแรง
ควรแยกภาวะแคระแกร็นของต่อมใต้สมองจากความล่าช้าทางกายที่เกิดจากความผิดปกติของระบบเผาผลาญเรื้อรัง (ในโรคของตับ ไต ระบบทางเดินอาหาร) ภาวะขาดออกซิเจนเรื้อรัง (ในโรคของระบบหัวใจและหลอดเลือดและระบบทางเดินหายใจ ในโรคโลหิตจาง); กับโรคระบบของระบบกล้ามเนื้อและโครงกระดูก (โรคกระดูกอ่อน โรคกระดูกพรุน โรคกระดูกไม่เรียบ โรคเอ็กโซสโทซิส) ฯลฯ
การเจริญเติบโตที่ช้าลงตามหน้าที่ (ตามธรรมชาติ) มักพบในช่วงวัยแรกรุ่นตอนปลายในวัยรุ่นที่ดูแข็งแรงดี เราพบว่าสาเหตุหลักมาจากการที่ฮอร์โมนเพศทำงานไม่เพียงพอชั่วคราว การหลั่งฮอร์โมนเพศมักไม่ลดลงหรือลดลงเล็กน้อย การกระตุ้นฮอร์โมนเพศสามารถเร่งการพัฒนาและการเจริญเติบโตทางเพศได้
ภาวะเตี้ยของครอบครัวควรได้รับการพิจารณาว่าเป็นรูปแบบหนึ่งของพัฒนาการทางสรีรวิทยา
สิ่งที่ต้องตรวจสอบ?
วิธีการตรวจสอบ?
ต้องการทดสอบอะไรบ้าง?
ใครจะติดต่อได้บ้าง?
การรักษา ภาวะแคระแกร็น
การรักษาภาวะแคระแกร็นเป็นกระบวนการที่ยาวนาน ซึ่งบังคับให้แพทย์ต้องแบ่งวิธีการรักษาตามระยะเวลาเพื่อให้ได้ผลการรักษาที่ดีที่สุด โดยต้องปฏิบัติตามหลักการพื้นฐาน 2 ประการ ได้แก่
- การประมาณค่าสูงสุดของการพัฒนาที่เกิดจากการรักษาต่อสภาวะทางสรีรวิทยา
- ประหยัดพื้นที่การเจริญเติบโตของเอพิฟิเซียล
ประสบการณ์หลายปีในการรักษาภาวะแคระแกร็นทำให้เราพิจารณารูปแบบการบำบัดแบบเป็นขั้นตอนต่อไปนี้ว่าเหมาะสมหรือไม่ การวินิจฉัยภาวะแคระแกร็นในผู้ป่วยผู้ใหญ่โดยปกติจะไม่ทำให้เกิดข้อสงสัย ในเด็กเล็ก หากภาพทางคลินิกไม่ชัดเจน จำเป็นต้องมีช่วงเวลาในการวินิจฉัย: 6-12 เดือนภายใต้การสังเกตโดยไม่ใช้ฮอร์โมนบำบัด ในช่วงเวลานี้ จะมีการกำหนดให้มีการรักษาเสริมความแข็งแรงทั่วไปที่ซับซ้อน โภชนาการที่เหมาะสมพร้อมการเพิ่มปริมาณโปรตีนจากสัตว์ ผักและผลไม้ในอาหาร วิตามิน A และ D แคลเซียมและฟอสฟอรัส การไม่มีการเปลี่ยนแปลงที่เพียงพอในด้านการเจริญเติบโตและการพัฒนาทางกายภาพเมื่อเทียบกับพื้นหลังนี้และการตรวจพบความผิดปกติของต่อมไร้ท่อระหว่างการตรวจเป็นพื้นฐานสำหรับการเริ่มการบำบัดด้วยฮอร์โมน
การบำบัดทางพยาธิวิทยาสำหรับภาวะแคระแกร็นจากต่อมใต้สมองคือการใช้ฮอร์โมนการเจริญเติบโตของมนุษย์เนื่องจากการเกิดภาวะแคระแกร็นส่วนใหญ่ขึ้นอยู่กับการขาดฮอร์โมนรูปแบบใดรูปแบบหนึ่งอย่างไม่ต้องสงสัย เนื่องจากฮอร์โมนชนิดนี้มีลักษณะเฉพาะในสายพันธุ์ จึงมีเพียงฮอร์โมนการเจริญเติบโตของมนุษย์และลิงเท่านั้นที่ออกฤทธิ์ต่อมนุษย์ ยาที่แยกได้จากต่อมใต้สมองของผู้ที่เสียชีวิตจากโรคที่ไม่ติดเชื้อและไม่ใช่เนื้องอกนั้นใช้กันอย่างแพร่หลายในคลินิก ฮอร์โมนการเจริญเติบโตของมนุษย์ได้มาจากการสังเคราะห์แบคทีเรียโดยใช้ Escherichia coli โดยวิธีพันธุวิศวกรรม ฮอร์โมนการเจริญเติบโตของมนุษย์ยังสังเคราะห์ขึ้นทางเคมีด้วย แต่มีราคาแพงมากและแทบจะไม่ได้นำมาใช้ในคลินิก ผู้ป่วยที่มีหลักฐานว่าขาดฮอร์โมนการเจริญเติบโตภายในร่างกาย โดยมีโครงกระดูกที่แยกตัวได้ไม่เกินระดับปกติที่อายุ 13-14 ปี จะได้รับการคัดเลือกให้รับการรักษาด้วยฮอร์โมนการเจริญเติบโต ไม่มีข้อจำกัดด้านอายุสำหรับการรักษา
ขนาดยาที่มีประสิทธิภาพต่ำสุดที่สามารถใช้ได้ในช่วงแรกของการรักษาคือ 0.03-0.06 มก./กก. ของน้ำหนักตัว ขนาดยาที่มีประสิทธิภาพสูงสุดคือ 2-4 มก. 3 ครั้งต่อสัปดาห์ การเพิ่มขนาดยาครั้งเดียวเป็น 10 มก. ไม่ได้มาพร้อมกับผลการเจริญเติบโตที่เพิ่มขึ้นอย่างเพียงพอ แต่ทำให้เกิดการสร้างแอนติบอดีต่อโซมาโทโทรปินอย่างรวดเร็ว
ในประเทศของเรา การศึกษาฮอร์โมนการเจริญเติบโตของมนุษย์ได้ดำเนินการมาตั้งแต่ปี 1960 มีการทดสอบแผนการรักษาสองแบบ ได้แก่ แบบต่อเนื่องและแบบเป็นช่วง ๆ โดยมีระยะเวลาการรักษา 2-3 เดือน และมีระยะเวลาระหว่างการรักษาเท่ากัน การเพิ่มขึ้นของส่วนสูงโดยเฉลี่ยของผู้ป่วยในปีแรกของการรักษาคือ 9.52±0.39 ซม. น้ำหนักตัวเพิ่มขึ้น 4.4±0.14 กก. ด้วยการรักษาต่อเนื่องในระยะยาว การเพิ่มขึ้นของส่วนสูงโดยเฉลี่ยคือ 0.82 ซม./เดือน น้ำหนักตัว - 0.38 กก./เดือน แบบเป็นช่วง ๆ - 0.75 ซม./เดือน และ 0.4 กก./เดือน ตามลำดับ การรักษาต่อเนื่องทำให้ส่วนสูงเพิ่มขึ้นอย่างรวดเร็วและมีผลลดลงอย่างรวดเร็วหลังจาก 1-1.5 ปี การรักษาแบบเป็นช่วง ๆ จะทำให้ประสิทธิภาพคงอยู่ได้ 3-4 ปี ซึ่งทำให้เราสามารถพิจารณาแผนการรักษาแบบเป็นช่วง ๆ ที่เหมาะสมยิ่งขึ้นได้ การกำหนดระดับของ IGF-I (somatomedin C) สามารถใช้เป็นตัวบ่งชี้ความไวของผู้ป่วยต่อการรักษาด้วยยา somatotropin ได้อย่างน่าเชื่อถือ การเพิ่มขึ้นของปริมาณ IGF-I หลังจากการแนะนำฮอร์โมน somatotropin ช่วยให้สามารถคาดการณ์ผลเชิงบวกของการบำบัดได้ ข้อดีที่สำคัญประการหนึ่งของการรักษาด้วยฮอร์โมน somatotropin คือไม่มีการเร่งการสร้างกระดูกให้มากขึ้นเมื่อเทียบกับพื้นหลัง
วิธีการรักษาภาวะแคระแกร็นที่สำคัญที่สุดคือการใช้สเตียรอยด์ที่กระตุ้นการเจริญเติบโตโดยเพิ่มการสังเคราะห์โปรตีนและเพิ่มระดับฮอร์โมนโซมาโทโทรปิกภายในร่างกาย การรักษาจะดำเนินการเป็นเวลาหลายปีโดยค่อย ๆ เปลี่ยนยาบางชนิดด้วยยาอื่น ๆ จากสารที่ออกฤทธิ์น้อยลงเป็นสารที่ออกฤทธิ์มากขึ้น การเปลี่ยนแปลงในยาที่กระตุ้นการเจริญเติบโตจะระบุไว้เมื่อผลการเจริญเติบโตลดลงหลังจาก 2-3 ปีซึ่งนำไปสู่การเจริญเติบโตที่เพิ่มขึ้น การรักษาจะดำเนินการเป็นรายคอร์ส (ช่วงพักควรเป็นครึ่งหนึ่งของระยะเวลาการรักษา) ในกรณีที่ติดยา แนะนำให้หยุดนานขึ้น (สูงสุด 4-6 เดือน) กำหนดให้ใช้สเตียรอยด์ที่กระตุ้นการเจริญเติบโตครั้งละหนึ่งชนิดเท่านั้น การใช้ยา 2 ชนิดขึ้นไปร่วมกันนั้นไม่เหมาะสมเนื่องจากจะไม่เพิ่มผลการเผาผลาญและการเจริญเติบโตของยา ทั้งนี้ขึ้นอยู่กับอายุของผู้ป่วยเป็นหลักและระดับของการแยกตัวของโครงกระดูกในช่วงเริ่มต้นการรักษา ผลลัพธ์ที่ดีที่สุดพบในผู้ป่วยที่มีอายุต่ำกว่า 16-18 ปีที่มีการสร้างกระดูกไม่เกินระดับลักษณะเฉพาะของเด็กอายุ 14 ปี แนะนำให้เริ่มการรักษาทันทีหลังจากการวินิจฉัย โดยปกติจะเริ่มตั้งแต่อายุ 5-7 ปี ก่อนการรักษา จำเป็นต้องหลีกเลี่ยงการกำหนดฮอร์โมนเพศและฮอร์โมนเพศ ซึ่งกระตุ้นการเจริญเติบโตและเร่งการแยกกระดูกในเวลาเดียวกัน หลักการของการกำหนดขนาดยาสเตียรอยด์อนาโบลิกคือจากขนาดยาที่มีประสิทธิผลต่ำสุดไปจนถึงขนาดยาที่เพิ่มขึ้นทีละน้อย ขนาดยาที่แนะนำของยาที่พบบ่อยที่สุด: เนโรโบล (เมธานโดรสเตนอล, ไดอานาโบล) - 0.1-0.15 มก. ต่อน้ำหนักตัว 1 กก. ต่อวัน รับประทาน เนโรโบลิล (ดูราโบลิน) - 1 มก. ต่อน้ำหนักตัว 1 กก. ต่อเดือน ฉีดเข้ากล้ามเนื้อ ขนาดยาต่อเดือนจะฉีด 2-3 ครั้ง ตามลำดับ หลังจาก 15 หรือ 10 วัน เรตาโบลิล (เดคา-ดูราโบลิน) - 1 มก. ต่อน้ำหนักตัว 1 กก. ฉีดเข้ากล้ามเนื้อเดือนละครั้ง การใช้ยาเกินขนาดที่กำหนดอาจทำให้เกิดการสร้างแอนโดรเจนได้ ในปริมาณที่เหมาะสมทางสรีรวิทยา สารประกอบเหล่านี้ไม่มีผลต่อสภาพของอวัยวะเพศและการแยกตัวของกระดูก ซึ่งทำให้สามารถใช้ได้นานในผู้ป่วยทั้งสองเพศ เด็กผู้หญิงควรอยู่ภายใต้การดูแลของสูตินรีแพทย์ เนื่องจากในกรณีที่ใช้ยาเกินขนาดหรือมีความไวต่อความรู้สึกเพิ่มขึ้น ผู้ป่วยบางรายอาจมีอาการของการสร้างเพศชาย ซึ่งจะลดลงอย่างรวดเร็วเมื่อหยุดการรักษา ยาที่รับประทานซึ่งถูกทำให้เป็นเมทิลเลชั่นเป็นเอทิลเลชั่นในตำแหน่งที่ 17 อาจทำให้เกิดผลคั่งน้ำดีได้ ดังนั้น ในโรคตับ ควรเน้นที่สารประกอบอนาโบลิกที่ฉีดเข้าเส้นเลือด หรือยาที่รับประทานควรใช้ร่วมกับสารที่ทำให้เกิดอาการคอเลเรติก การรักษาด้วยสเตียรอยด์ที่ทำให้เกิดอาการแอนโดรเจนนั้นพบได้น้อยมาก (อาการคัน ผื่น) ในกรณีที่ไม่มีภาวะแทรกซ้อน จะใช้สเตียรอยด์อนาโบลิกตราบเท่าที่ยังเห็นผลการเจริญเติบโต (นานถึง 16-18 ปี และบางครั้งนานกว่านั้น) การรักษาจะดำเนินการควบคู่ไปกับการบำบัดเสริมความแข็งแรงทั่วไป
หากผู้ป่วยมีอาการของภาวะไทรอยด์ทำงานน้อย จะมีการสั่งยารักษาไทรอยด์ เช่น ไทรอกซิน ไทรอยด์ริน ไทโรทอม พร้อมกันในขนาดที่เลือกไว้เป็นรายบุคคล
ในการรักษาเด็กผู้ชาย ขั้นตอนต่อไปคือการใช้ยาฮอร์โมนโกนาโดโทรปินในผู้ชาย ยานี้ใช้ไม่เร็วกว่า 15-16 ปี และมักจะใช้ในวัยที่โตกว่านั้นเพื่อกระตุ้นเซลล์ Leydig ซึ่งเร่งการพัฒนาและการเจริญเติบโตทางเพศ (เนื่องจากกิจกรรมอนาโบลิกของแอนโดรเจนในเซลล์) ขนาดยา 1,000 ถึง 1,500 IU ใช้ 1-2 ครั้งต่อสัปดาห์โดยฉีดเข้ากล้ามเนื้อในหลักสูตร 2 เดือน ไม่เกิน 2-3 ครั้งต่อปี หากผลการรักษาไม่สมบูรณ์ การรักษาด้วยฮอร์โมนโกนาโดโทรปินในผู้ชายอายุ 16 ปีขึ้นไปจะสลับกับการให้แอนโดรเจนในขนาดเล็กน้อย (เมทิลเทสโทสเตอโรนในขนาด 5-10 มก./วัน ใต้ลิ้น)
เด็กสาวอายุมากกว่า 16 ปีสามารถเริ่มการรักษาด้วยเอสโตรเจนปริมาณเล็กน้อยเพื่อจำลองรอบเดือนปกติ การรักษาจะดำเนินการเป็นเวลา 3 สัปดาห์ของทุกเดือน จากนั้นจึงเว้นช่วงการรักษา ในระยะที่ 2 ของรอบเดือน ตั้งแต่สัปดาห์ที่ 3 อาจกำหนดให้ฮอร์โมนโกนาโดโทรปินในขนาด 1,000-1,500 IU สัปดาห์ละ 3-5 ครั้ง หรือยาที่มีฤทธิ์กระตุ้นการตกไข่ (เพร็กนิน โปรเจสเตอโรน)
ขั้นตอนสุดท้ายของการรักษา (หลังจากปิดโซนการเจริญเติบโต) คือการให้ฮอร์โมนเพศในปริมาณที่เหมาะสมกับเพศของผู้ป่วยอย่างต่อเนื่อง เพื่อให้อวัยวะเพศพัฒนาเต็มที่ ลักษณะทางเพศรอง รับรองความต้องการทางเพศและสมรรถภาพทางเพศ การเตรียมเอสโตรเจนและโปรเจสโตเจนร่วมกัน (non-ovlon, bisecurin, infekundin, rigevidon) สะดวกสำหรับการรักษาผู้ป่วยหญิง และการเตรียมแอนโดรเจนออกฤทธิ์นาน (testenate, sustanon-250, omnadren-250) สะดวกสำหรับการรักษาผู้ป่วยชาย
ดำเนินการรักษาเพื่อเสริมสร้างความแข็งแรงทั่วไป (ระบบการปกครอง อาหารโปรตีนและผัก การบำบัดด้วยวิตามิน สารกระตุ้นชีวภาพ) ระบุการใช้การเตรียมสังกะสี ซึ่งกลไกการออกฤทธิ์มีบทบาทหลักในการเพิ่มกิจกรรมของ IGF-1 (อินซูลินไลค์โกรทแฟกเตอร์ I)
ในกรณีที่มีพยาธิสภาพทางอินทรีย์จากระบบประสาทส่วนกลาง จะให้การรักษาด้วยยาต้านการอักเสบ การดูดซึมกลับ และการทำให้ร่างกายขาดน้ำ การบำบัดแบบเป็นระบบที่มุ่งเป้าจะให้ผลดี จากผลการรักษาแบบเป็นขั้นตอนในระยะยาว ผู้ป่วย 148 ราย (80.4%) จาก 175 รายที่มีภาวะแคระแกร็นทั้งชายและหญิงสามารถมีความสูงเกิน 130 ซม. ผู้ป่วย 92 ราย (52.5%) สูงเกิน 140 ซม. และผู้ป่วย 32 ราย (18.3%) สูง 150-160 ซม. หรือมากกว่า ในเวลาเดียวกัน ผู้ป่วย 37 ราย (21.2%) สูง 30 ซม. ผู้ป่วย 107 ราย (61.1%) สูง 31-50 ซม. และผู้ป่วย 31 ราย (17.7%) สูง 51-60 ซม. หรือมากกว่า
พยากรณ์
การพยากรณ์โรคขึ้นอยู่กับรูปแบบของภาวะแคระแกร็น ในภาวะแคระแกร็นประเภททางพันธุกรรม การพยากรณ์โรคสำหรับชีวิตนั้นดี ในกรณีที่มีเนื้องอกต่อมใต้สมองและความเสียหายทางร่างกายต่อระบบประสาทส่วนกลาง จะถูกกำหนดโดยพลวัตของการพัฒนากระบวนการทางพยาธิวิทยาหลัก วิธีการบำบัดสมัยใหม่ได้เพิ่มความสามารถทางกายภาพและความสามารถในการทำงานของผู้ป่วยอย่างมีนัยสำคัญและยืดอายุขัยของพวกเขา ในช่วงระยะเวลาของการรักษาที่ใช้งานอยู่ ผู้ป่วยจะต้องได้รับการตรวจจากแพทย์ทุก 2-3 เดือนพร้อมการบำบัดรักษาทุก 6-12 เดือน
การจ้างงานผู้ป่วยให้เหมาะสมกับความสามารถทางสติปัญญาและร่างกายถือเป็นสิ่งสำคัญอย่างยิ่งต่อการปรับตัวทางสังคมของผู้ป่วย
ควรเลือกอาชีพที่ไม่ต้องใช้แรงกายมาก แต่ให้สามารถแสดงความสามารถทางสติปัญญา ความสามารถในการทำงานที่ต้องใช้ความแม่นยำ และภาษาได้


 [
[