ผู้เชี่ยวชาญทางการแพทย์ของบทความ
สิ่งตีพิมพ์ใหม่
โรคพิษสุนัขบ้าในเด็ก
ตรวจสอบล่าสุด: 04.07.2025

เนื้อหา iLive ทั้งหมดได้รับการตรวจสอบทางการแพทย์หรือตรวจสอบข้อเท็จจริงเพื่อให้แน่ใจว่ามีความถูกต้องตามจริงมากที่สุดเท่าที่จะเป็นไปได้
เรามีแนวทางการจัดหาที่เข้มงวดและมีการเชื่อมโยงไปยังเว็บไซต์สื่อที่มีชื่อเสียงสถาบันการวิจัยทางวิชาการและเมื่อใดก็ตามที่เป็นไปได้ โปรดทราบว่าตัวเลขในวงเล็บ ([1], [2], ฯลฯ ) เป็นลิงก์ที่คลิกได้เพื่อการศึกษาเหล่านี้
หากคุณรู้สึกว่าเนื้อหาใด ๆ ของเราไม่ถูกต้องล้าสมัยหรือมีข้อสงสัยอื่น ๆ โปรดเลือกแล้วกด Ctrl + Enter
โรคพิษสุนัขบ้าหรือโรคกลัวน้ำ เป็นโรคไวรัสเฉียบพลันที่แพร่กระจายผ่านการกัดของสัตว์ที่ติดเชื้อ ส่งผลให้ระบบประสาทได้รับความเสียหายและเกิดโรคสมองอักเสบรุนแรงซึ่งอาจเสียชีวิตได้
ระบาดวิทยา
โรคพิษสุนัขบ้าเป็นภัยร้ายแรงด้านสาธารณสุขมาตั้งแต่สมัยโบราณ ปัจจุบันมีผู้เสียชีวิตจากไวรัสชนิดนี้ประมาณ 59,000 รายต่อปี ซึ่งเกือบทั้งหมดติดต่อมาจากการถูกสุนัขกัด ไวรัสชนิดนี้ส่งผลกระทบทางเศรษฐกิจอย่างมากต่อประเทศกำลังพัฒนา โดยเฉพาะในแอฟริกาและเอเชีย ซึ่งเป็นประเทศที่ได้รับผลกระทบน้อยที่สุด อย่างไรก็ตาม แม้จะมีอัตราการเสียชีวิตเกือบ 100% โรคพิษสุนัขบ้าในสุนัขก็เป็นโรคที่ป้องกันได้ และตัวอย่างในอดีตของการกำจัดโรคพิษสุนัขบ้าในสุนัขในโลกที่พัฒนาแล้วก็เป็นเครื่องยืนยันเรื่องนี้ [ 1 ]
สาเหตุ โรคพิษสุนัขบ้า
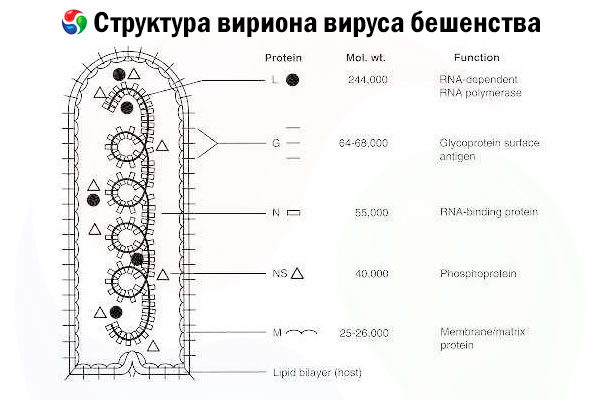
ตัวการก่อโรคคือไวรัสเรบีส์ (RV) ซึ่งเป็นไวรัส RNA สายลบใน ตระกูล Rhabdovirusมีขนาดประมาณ 60 นาโนเมตร × 180 นาโนเมตร
ประกอบด้วยแกนโปรตีนชั้นในหรือนิวคลีโอแคปซิดที่มีกรดนิวคลีอิก และเยื่อหุ้มชั้นนอกซึ่งเป็นไบเลเยอร์ที่มีไขมันหุ้มด้วยสไปก์ไกลโคโปรตีนทรานส์เมมเบรน มีโครงสร้างจีโนมแบบโมดูลาร์ที่ค่อนข้างเรียบง่ายและเข้ารหัสโปรตีนโครงสร้าง 5 ชนิด ได้แก่
- RNA-dependent RNA polymerase (L),
- นิวคลีโอโปรตีน (N)
- โปรตีนฟอสโฟรีเลต (P)
- โปรตีนเมทริกซ์ (M) และ
- ไกลโคโปรตีนบนพื้นผิวด้านนอก (G)
โปรตีน N, P และ L ร่วมกับ RNA ของจีโนมจะสร้างคอมเพล็กซ์ไรโบนิวคลีโอโปรตีน G เป็นแอนติเจน RV เพียงชนิดเดียวที่สามารถกระตุ้นการสร้างแอนติบอดี RV ที่เป็นกลาง ซึ่งเป็นตัวกระตุ้นภูมิคุ้มกันหลักต่อการติดเชื้อ RV ที่ร้ายแรง ในทางกลับกัน คอมเพล็กซ์ไรโบนิวคลีโอโปรตีนได้รับการพิสูจน์แล้วว่าเป็นแอนติเจน RV หลักที่สามารถกระตุ้นเซลล์ T CD4+ ซึ่งสามารถเพิ่มการผลิตแอนติบอดี RV ที่เป็นกลางได้ผ่านการจดจำแอนติเจนภายในโครงสร้าง[ 2 ] คอมเพล็กซ์ไรโบนิวคลีโอโปรตีนอาจมีบทบาทสำคัญในการสร้างความจำทางภูมิคุ้มกันและภูมิคุ้มกันระยะยาว[ 3 ]
การจำแนกประเภทและชนิดของแอนติเจน
สกุล Lyssavirus ประกอบด้วยไวรัสโรคพิษสุนัขบ้าและไวรัสโรคพิษสุนัขบ้าที่เกี่ยวข้องทั้งทางแอนติเจนและทางพันธุกรรม ได้แก่ ไวรัสค้างคาว Lagos, Mokola และ Duvenhage รวมถึงไวรัส Lyssavirus ในค้างคาวยุโรปอีก 2 ชนิดย่อย การศึกษาการป้องกันแบบไขว้ระบุว่าสัตว์ที่ได้รับวัคซีนป้องกันโรคพิษสุนัขบ้าแบบดั้งเดิมอาจไม่ได้รับการป้องกันอย่างเต็มที่เมื่อได้รับวัคซีน Lyssavirus ชนิดอื่น
ไวรัสโรคพิษสุนัขบ้าสามารถจำแนกได้เป็นชนิดคงที่ (ปรับตัวโดยผ่านเข้าไปในสัตว์หรือเพาะเลี้ยงเซลล์) หรือชนิดตามท้องถนน (ชนิดป่า) การใช้แอนติบอดีโมโนโคลนอลและการจัดลำดับพันธุกรรมเพื่อแยกไวรัสโรคพิษสุนัขบ้าตามท้องถนนช่วยให้ระบุตัวแปรของไวรัสที่มาจากแหล่งกักเก็บโฮสต์หลักทั่วโลกได้ และช่วยในการแนะนำแหล่งที่น่าจะเป็นไปได้ของการสัมผัสเชื้อในมนุษย์เมื่อไม่มีประวัติการถูกสัตว์กัดอย่างชัดเจนในผู้ป่วย[ 8 ]
กลไกการเกิดโรค
แหล่งกักเก็บและแหล่งแพร่เชื้อหลักในสัตว์ป่า ได้แก่ หมาป่า จิ้งจอก หมาจิ้งจอก ค้างคาว และในสัตว์เลี้ยง เช่น สุนัขและแมว ซึ่งพบได้น้อย ได้แก่ ม้า วัว หมู หนู เป็นต้น การติดต่อจากคนสู่คนนั้นเป็นไปได้ แต่พบได้น้อยมาก นี่คือโรคติดต่อจากสัตว์สู่คนโดยทั่วไป ผู้คนติดเชื้อพิษสุนัขบ้าจากสุนัขเป็นหลัก
หลังจากที่มนุษย์ถูกสัตว์ป่วยกัด ไวรัสจะขยายพันธุ์ในเนื้อเยื่อของกล้ามเนื้อบริเวณที่ถูกกัด จากนั้นเมื่อไปถึงปลายประสาทส่วนปลายที่รับความรู้สึกแล้ว ไวรัสจะแพร่กระจายเข้าสู่เซลล์ประสาทสั่งการด้วยแรงเหวี่ยง เวลาที่ไวรัสจะเคลื่อนที่และเข้าสู่สมองจะได้รับผลกระทบขึ้นอยู่กับตำแหน่งที่ถูกกัด ในกรณีที่ถูกกัดที่ศีรษะและใบหน้าอย่างรุนแรง ไวรัสจะเข้าถึงระบบประสาทส่วนกลางได้ภายใน 15-20 วัน และในกรณีที่ผิวหนังของลำตัวและแขนขาได้รับความเสียหายเล็กน้อย และส่งผลให้ได้รับเชื้อก่อโรคในปริมาณเล็กน้อย กระบวนการเคลื่อนย้ายไวรัสไปยังระบบประสาทส่วนกลางอาจล่าช้าออกไปเป็นเวลาหลายเดือนหรืออาจถึง 1-1.5 ปี เมื่อไวรัสเข้าถึงระบบประสาทส่วนกลางแล้ว ไวรัสจะฝังตัวอยู่ในเนื้อเยื่อของสมองและไขสันหลัง โดยส่วนใหญ่อยู่ในเซลล์ประสาทของเมดัลลา ออบลองกาตา เขาแอมมอน และฐานของสมอง ในไขสันหลัง เขาส่วนหลังได้รับผลกระทบมากที่สุด จากระบบประสาทส่วนกลาง ไวรัสจะเคลื่อนตัวไปตามลำต้นประสาทโดยเหวี่ยงไปที่ต่อมน้ำลาย จากนั้นไวรัสจะขยายพันธุ์และขับออกมาพร้อมกับน้ำลาย
แนวคิดในการเกิดโรคพิษสุนัขบ้า
ไวรัส RV มีช่วงการแพร่เชื้อที่กว้างและสามารถแพร่เชื้อไปยังสัตว์เลี้ยงลูกด้วยนมได้เกือบทุกชนิด แม้ว่าจะมีรายงานการแพร่เชื้อ RV หลายเส้นทาง แต่การติดเชื้อตามธรรมชาติส่วนใหญ่มักเกิดขึ้นจากการถูกกัด นอกจากการถูกกัดแล้ว การบริโภคซากสัตว์ที่ติดเชื้อ RV ยังส่งเสริมการติดเชื้อไวรัสโรคพิษสุนัขบ้าในสุนัขจิ้งจอกอาร์กติก และพบว่าการสัมผัสไวรัส RV กับเยื่อเมือกเป็นอีกเส้นทางหนึ่งในการแพร่เชื้อ[ 9 ] ในบางสถานการณ์ที่ไม่ปกติ เช่น การปล่อยไวรัส RV ในรูปละอองในห้องปฏิบัติการโดยไม่ได้ตั้งใจ หรือไวรัส RV ในรูปละอองในถ้ำที่มีค้างคาวอาศัยอยู่เป็นจำนวนมาก[ 10 ] อาจเกิดการแพร่เชื้อในรูปละอองได้
ยังไม่ชัดเจนว่าสายพันธุ์ RV ที่ปรับตัวให้เข้ากับหนูหรือที่ปรับตัวให้เข้ากับการเพาะเลี้ยงเนื้อเยื่อจะจำลองตัวเองที่บริเวณที่ฉีดวัคซีนก่อนจะเข้าสู่ระบบประสาทส่วนกลางหรือไม่ ในขณะที่การติดเชื้อทางกล้ามเนื้อในหนูแฮมสเตอร์หรือแรคคูนที่ติดเชื้อ RV ในระยะเริ่มต้นในหนูทดลองเผยให้เห็นการจำลองตัวเองของ RV ในเซลล์กล้ามเนื้อลายก่อนที่ไวรัสจะบุกรุกแอกซอนของเซลล์ประสาทสั่งการผ่านจุดเชื่อมต่อระหว่างนิวรอนกับกล้ามเนื้อ[ 11 ],[ 12 ] การติดเชื้อทางกล้ามเนื้อในหนูที่ติดเชื้อ RV CVS-24 ที่ปรับตัวให้เข้ากับหนูแสดงให้เห็นว่า RV จะอพยพไปยังระบบประสาทส่วนกลางโดยตรงโดยไม่มีการจำลองตัวเองที่บริเวณที่ฉีดวัคซีน[ 13 ] เมื่ออยู่ในปลายของแอกซอนที่ยังไม่มีไมอีลินแล้ว RV จะถูกเคลื่อนย้ายย้อนกลับไปยังตัวเซลล์
ผลการศึกษาล่าสุดชี้ให้เห็นว่าการขนส่งถุงแอกซอนอาจเป็นกลยุทธ์สำคัญในการเคลื่อนย้ายไวรัสในระยะไกลในแอกซอน[ 14 ] มีการประเมินว่า RV เคลื่อนที่ภายในแอกซอนด้วยอัตรา 3 มม./ชม.[ 15 ] จากนั้นการติดเชื้อจะแพร่กระจายผ่านห่วงโซ่ของเซลล์ประสาทที่เชื่อมต่อกันด้วยจุดเชื่อมต่อแบบซินแนปส์ อย่างไรก็ตาม กลไกที่แน่นอนที่ส่งเสริมการแพร่กระจายแบบทรานส์ซินแนปส์ยังคงไม่เป็นที่ทราบแน่ชัด หลังจากติดเชื้อในสมอง ไวรัสจะแพร่กระจายแบบเหวี่ยงไปที่ระบบประสาทส่วนปลายและระบบประสาทอัตโนมัติในอวัยวะส่วนปลายหลายแห่ง[ 16 ] ในระยะสุดท้ายของวงจรการติดเชื้อ RV จะเคลื่อนที่ไปที่ต่อมน้ำลาย หลังจากจำลองแบบในเซลล์อะซีนาร์ที่สร้างเมือกแล้ว ไวรัสจะถูกปล่อยลงในน้ำลายและพร้อมที่จะส่งต่อไปยังโฮสต์ตัวต่อไป[ 17 ]
ในส่วนของพยาธิวิทยาที่เกิดจากไวรัสโรคพิษสุนัขบ้า การตายของเซลล์แบบอะพอพโทซิสถูกเสนอให้เป็นกลไกก่อโรคที่มีศักยภาพในแบบจำลองโรคพิษสุนัขบ้าในหนูที่ติดเชื้อ RV สายพันธุ์คงที่[ 18 ] กลไกก่อโรคที่อาจมีส่วนทำให้เกิดความผิดปกติของระบบประสาทส่วนกลางอย่างรุนแรงซึ่งเป็นลักษณะเฉพาะของโรคพิษสุนัขบ้าคือการทำงานของเซลล์ประสาทที่บกพร่อง การแสดงออกของยีนได้รับการแสดงให้เห็นว่าลดลงอย่างเห็นได้ชัดในเซลล์ประสาทที่ติดเชื้อ RV ส่งผลให้การสังเคราะห์โปรตีนถูกระงับโดยทั่วไป[ 19 ] และการศึกษาหลายชิ้นแสดงให้เห็นว่าการส่งสัญญาณประสาทบกพร่องหลังจากติดเชื้อ RV เจียงแสดงให้เห็นว่าการจับกันของตัวรับอะเซทิลโคลีนกับเนื้อสมองหนูที่ติดเชื้อลดลงเมื่อเทียบกับกลุ่มควบคุม[ 20 ] การปลดปล่อยและการจับกันของเซโรโทนินที่บกพร่อง ซึ่งเป็นสารสื่อประสาทที่เกี่ยวข้องกับการควบคุมวงจรการนอนหลับ การรับรู้ความเจ็บปวด และพฤติกรรม ยังพบในสมองหนูที่ติดเชื้อ RV อีกด้วย [ 21 ], [ 22 ] นอกจากจะส่งผลต่อการส่งสัญญาณประสาทแล้ว การติดเชื้อที่ห้องล่างขวายังอาจส่งผลต่อช่องไอออนอีกด้วย เซลล์นิวโรบลาสโตมาของหนูที่ติดเชื้อจะแสดงการแสดงออกของช่องโซเดียมที่ควบคุมแรงดันไฟฟ้าที่ลดลง ซึ่งอาจขัดขวางศักยะงานและนำไปสู่ความบกพร่องในการทำงานในที่สุด [ 23 ]
นอกจากการไม่มีรอยโรคร้ายแรงในระบบประสาทส่วนกลางแล้ว โรคพิษสุนัขบ้าในมนุษย์ส่วนใหญ่จะไม่ก่อให้เกิดการตอบสนองทางภูมิคุ้มกันภายใน 7 ถึง 10 วันหลังจากเริ่มมีอาการทางคลินิก ความแตกต่างอย่างลึกซึ้งระหว่างการเกิดโรคพิษสุนัขบ้าและการติดเชื้อในระบบประสาทส่วนกลางจากไวรัสหรือแบคทีเรียอื่นๆ ส่วนใหญ่ได้รับการสนับสนุนเพิ่มเติมด้วยข้อเท็จจริงที่ว่าการกดภูมิคุ้มกันนั้นไม่มีประสิทธิภาพหรือเป็นอันตรายต่อผลลัพธ์ของโรคพิษสุนัขบ้า[ 24 ] ระดับการตอบสนองทางภูมิคุ้มกันที่ต่ำซึ่งมักพบในเหยื่อโรคพิษสุนัขบ้านั้นน่าฉงน เพราะไม่สามารถอธิบายได้ด้วยภูมิคุ้มกันที่ไม่ดีของแอนติเจน RV ในความเป็นจริง โปรตีน RV G และนิวคลีโอแคปซิดเป็นแอนติเจนของเซลล์ B และ T ที่มีศักยภาพเมื่อให้ทางหลอดเลือด [ 25 ] คำอธิบายที่เป็นไปได้สำหรับระดับต่ำของการตอบสนองภูมิคุ้มกันต่อ RV ในมนุษย์หรือสัตว์ที่เป็นโรคพิษสุนัขบ้าอาจเป็นเพราะการติดเชื้อ RV ของระบบประสาทส่วนกลางทำให้เกิดภาวะภูมิคุ้มกันบกพร่อง [ 26 ] และมีการเสนอว่า RV ใช้กลยุทธ์ที่ทำลายล้างซึ่งรวมถึงการป้องกันอะพอพโทซิสและการทำลายเซลล์ T ที่บุกรุก [ 27 ]
สายพันธุ์ RV ที่ลดความรุนแรงลงซึ่งได้รับการปรับให้เข้ากับเซลล์ที่ไม่ใช่เซลล์ประสาทมีความแตกต่างอย่างมีนัยสำคัญจากสายพันธุ์ RV ที่ก่อโรคตามท้องถนนในด้านความสามารถในการบุกรุกระบบประสาท ซึ่งหมายถึงความสามารถในการบุกรุก CNS จากบริเวณรอบนอก ในเรื่องนี้ สายพันธุ์ RV ที่ปรับให้เข้ากับการเพาะเลี้ยงเนื้อเยื่อขาดหรือมีความสามารถในการบุกรุก CNS จากบริเวณรอบนอกเพียงเล็กน้อย ในขณะที่สายพันธุ์ RV บนถนนหรือสายพันธุ์ RV ที่ปรับให้เข้ากับหนู เช่น CVS-24 นั้นเป็นสายพันธุ์ที่รุกรานสูง[ 28 ] ปัจจัยสำคัญที่เกี่ยวข้องกับการบุกรุกระบบประสาทของ RV ได้แก่ การดูดซึมไวรัส การขนส่งแอกซอน การแพร่กระจายผ่านซินแนปส์ และอัตราการจำลองแบบของไวรัส
จนกระทั่งเมื่อไม่นานนี้ ความรู้ของเราเกี่ยวกับพยาธิสภาพของ RV นั้นจำกัดอยู่เพียงเท่านั้น และส่วนใหญ่แล้วจะขึ้นอยู่กับการศึกษาเชิงพรรณนาของเชื้อ RV บนท้องถนนหรือการติดเชื้อในเชิงทดลองด้วยเชื้อสายพันธุ์ที่ลดความรุนแรงลงซึ่งดัดแปลงในห้องทดลอง การถือกำเนิดของเทคโนโลยีพันธุศาสตร์ย้อนกลับทำให้เราสามารถระบุองค์ประกอบของไวรัสที่กำหนดลักษณะทางพยาธิสภาพของ RV และทำความเข้าใจกลไกที่เกี่ยวข้องกับพยาธิสภาพของโรคพิษสุนัขบ้าได้ดีขึ้น
การระบุองค์ประกอบของไวรัสที่ควบคุมการได้มา การแพร่กระจายและการจำลองของไวรัสโรคพิษสุนัขบ้า
- องค์ประกอบของไวรัสที่เกี่ยวข้องกับการจับไวรัส
การติดเชื้อ RV เริ่มต้นด้วยการที่ไวรัสเกาะกับตัวรับในเซลล์ที่คาดว่าจะเป็น แม้ว่าจะมีการนำเสนอโมเลกุลบนพื้นผิวเยื่อหุ้มเซลล์หลายโมเลกุลที่เป็นตัวรับ RV รวมถึงตัวรับอะเซทิลโคลีนนิโคตินิก[ 29 ] โมเลกุลการยึดเกาะของเซลล์ประสาท[ 30 ] และตัวรับนิวโรโทรฟินที่มีความสัมพันธ์ต่ำ p75 NTR[ 31 ] แต่ยังไม่ชัดเจนว่าโมเลกุลเหล่านี้มีบทบาทในวงจรชีวิตของไวรัสเรบีส์หรือไม่ ในบริบทนี้ ได้มีการแสดงให้เห็นเมื่อไม่นานนี้ว่าปฏิสัมพันธ์ระหว่าง RV G กับ p75 NTR ไม่จำเป็นสำหรับการติดเชื้อ RV ของเซลล์ประสาทหลัก[ 32 ] หลังจากการจับกับตัวรับแล้ว RV จะถูกนำเข้าภายในเซลล์ผ่านการดูดกลืนหรือการดูดกลืนโดยตัวรับ [ 33 ] จากนั้นสภาพแวดล้อมที่มีค่า pH ต่ำภายในช่องเอนโดโซมจะกระตุ้นให้เกิดการเปลี่ยนแปลงโครงร่างใน RV G ซึ่งกระตุ้นให้เยื่อหุ้มไวรัสหลอมรวมกับเยื่อหุ้มเอนโดโซม จึงปลดปล่อย RNP เข้าสู่ไซโทพลาซึม [ 34 ] สำหรับไวรัส RV G มีบทบาทสำคัญในการดูดซึมของไวรัส โดยส่วนใหญ่มักจะเป็นปฏิกิริยากับตัวรับในเซลล์ที่คาดว่าจะช่วยให้ดูดซึมได้เร็วยิ่งขึ้น ในเรื่องนี้ ได้มีการพิสูจน์แล้วว่าความก่อโรคของสายพันธุ์ RV ที่ปรับตัวให้เข้ากับการเพาะเลี้ยงเนื้อเยื่อ (เช่น ERA, HEP และ CVS-11) มีความสัมพันธ์กับการมีอยู่ของตัวกำหนดที่ตำแหน่งแอนติเจน III ของโปรตีน G [ 35 ] การกลายพันธุ์ Arg → Gln ที่ตำแหน่ง 333 ในตำแหน่งแอนติเจนของโปรตีน ERA G ส่งผลให้การนำเข้าภายในของตัวแปร Gln333 RV ล่าช้ากว่าตัวแปรประเภทป่าถึงเจ็ดเท่า การกลายพันธุ์ Asn194→Lys194 ใน RV G ซึ่งอธิบายการกลับมาเกิดขึ้นใหม่ของฟีโนไทป์ก่อโรค มีความเกี่ยวข้องกับการลดลงอย่างมีนัยสำคัญในเวลาการนำเข้าสู่เซลล์[ 36 ] ยิ่งไปกว่านั้น การทดลองกับ RV แบบไคเมอริกแสดงให้เห็นว่าเวลาที่จำเป็นสำหรับการนำไวรัส RV เข้าสู่เซลล์เพิ่มขึ้นอย่างมีนัยสำคัญและความก่อโรคลดลงอย่างมากหลังจากการแทนที่ยีน G ของสายพันธุ์ SB RV ที่มีความก่อโรคสูง ซึ่งได้มาจากโคลน cDNA ของสายพันธุ์ RV-18 ที่เกี่ยวข้องกับค้างคาวที่ได้มาจากเงิน[ 37 ] ด้วยสายพันธุ์ SN ที่ถูกทำให้ลดความรุนแรงลงอย่างมาก ซึ่งแยกได้จากโคลน cDNA ของสายพันธุ์วัคซีน SAD B19 RV[ 38 ] ข้อมูลเหล่านี้ร่วมกันสนับสนุนแนวคิดที่ว่าจลนพลศาสตร์ของการดูดซึมไวรัส ซึ่งเป็นหน้าที่ของ RV G เป็นตัวกำหนดที่สำคัญของความก่อโรค RV
- องค์ประกอบของไวรัสที่เกี่ยวข้องกับการแพร่กระจายและการส่งต่อของไวรัส
คุณสมบัติเฉพาะตัวของไวรัสโรคพิษสุนัขบ้าคือความสามารถในการแพร่กระจายจากเซลล์หนึ่งไปยังอีกเซลล์หนึ่ง การสังเกตพบว่าไวรัส Gln333 ERA สูญเสียกิจกรรมการหลอมรวมระหว่างเซลล์ที่ขึ้นอยู่กับค่า pH ในหลอดทดลอง [ 39 ] และแสดงความสามารถในการแพร่กระจายจากเซลล์หนึ่งไปยังอีกเซลล์หนึ่งที่ลดลงอย่างมาก [ 40 ] แสดงให้เห็นว่า RV G ยังมีบทบาทสำคัญในการแพร่กระจายจากเซลล์หนึ่งไปยังอีกเซลล์หนึ่ง และด้วยเหตุนี้จึงสามารถแพร่เชื้อไวรัสได้ ซึ่งน่าจะเกิดจากกิจกรรมการหลอมรวมของมัน ความเป็นไปได้นี้ได้รับการสนับสนุนเพิ่มเติมโดยการค้นพบว่าอัตราการแพร่กระจายของ SPBNGAK ซึ่งเป็นสารก่อโรคที่กลับคืนสู่สภาวะปกติของ RV นั้นสูงเกือบสองเท่าของอัตราการแพร่กระจายที่กำหนดสำหรับไวรัส SPBNGA ที่ไม่ก่อโรค ที่น่าสนใจคือการกลายพันธุ์ Asn 194 → Lys 194 ในไวรัส G SPBNGAK ทำให้ค่า pH ของเกณฑ์การหลอมรวมของเยื่อหุ้มเซลล์เปลี่ยนไปเป็นค่า pH ที่สูงขึ้น ซึ่งสนับสนุนสมมติฐานที่ว่าค่า pH ของเกณฑ์การหลอมรวมของเยื่อหุ้มเซลล์ที่สูงขึ้นนั้นสัมพันธ์กับการแพร่กระจายของไวรัสที่เพิ่มขึ้น [ 41 ]
การศึกษาตัวบ่งชี้การติดเชื้อ RV ผ่านเส้นประสาทในหนู [ 42 ] และลิงแสม [ 43 ] แสดงให้เห็นว่าไวรัสโรคพิษสุนัขบ้าจะอพยพเฉพาะในทิศทางย้อนกลับในแอกซอน แม้ว่าโปรตีน RV หลายตัวจะเกี่ยวข้องกับกลไกการขนส่งของเซลล์ประสาท แต่ RV G ดูเหมือนจะมีบทบาทสำคัญในการแพร่กระจายการติดเชื้อ RV ผ่านเส้นประสาท ตัวอย่างเช่น ในขณะที่การติดเชื้อไวรัสโรคโลหิตจางติดเชื้อในม้า (EIAV) ที่มีการสร้างแบบจำเพาะด้วย RV G ส่งผลให้ไวรัสถ่ายโอนไปยังไขสันหลัง ไวรัส EIAV เดียวกันที่มีการสร้างแบบจำเพาะด้วยไวรัส stomatitis vesicular G ไม่สามารถเข้าสู่ระบบประสาทได้ [ 44 ] นอกจากนี้ การแพร่กระจายของไวรัสของ ERA G Arg 333 → Gln 333 ในระบบประสาทส่วนกลางลดลงอย่างมากเมื่อเทียบกับไวรัสกลายพันธุ์แบบป่า ซึ่งบ่งชี้เพิ่มเติมว่า RV G ที่ไม่เป็นอันตรายในการแพร่กระจายผ่านซินแนปส์ อย่างไรก็ตาม หลักฐานที่น่าเชื่อถือที่สุดสำหรับบทบาทสำคัญของ RV G ในการขนส่งผ่านซินแนปส์มาจากการติดเชื้อในกะโหลกศีรษะของหนูด้วยไวรัส RV ที่ขาด G แบบรีคอมบิแนนท์ ซึ่งแสดงให้เห็นว่าการติดเชื้อยังคงจำกัดอยู่เฉพาะเซลล์ประสาทที่บริเวณที่ฉีดวัคซีนโดยไม่มีหลักฐานใดๆ ของการแพร่กระจายไปยังเซลล์ประสาทรอง[ 45 ] อย่างไรก็ตาม มีแนวโน้มว่านอกเหนือจาก RV G แล้ว RV M ยังมีบทบาทในการแพร่กระจายไวรัสและการขนส่งผ่านซินแนปส์ด้วย ในเรื่องนี้ แสดงให้เห็นว่าการแพร่กระจายของ SN-BMBG RV variant ไคเมอริก ซึ่งประกอบด้วยทั้ง M และ G จาก SB ที่ก่อโรคได้รุนแรงนั้นสูงกว่าการแพร่กระจายของ SN-BG หรือ SN-BM variant ไคเมอริก ซึ่งประกอบด้วย G และ M จาก SB ตามลำดับ ซึ่งบ่งชี้ว่าปฏิสัมพันธ์ที่เหมาะสมที่สุดของ M กับ G อาจมีบทบาทสำคัญในการแพร่กระจายไวรัสจากเซลล์หนึ่งไปยังอีกเซลล์หนึ่ง [ 46 ] เนื่องจาก RV M รองรับการแตกหน่อของไวรัส [ 47 ] จึงเป็นไปได้ว่าการแพร่กระจายของตัวแปรไคเมอริก RV SN-BMBG ที่มีประสิทธิภาพมากขึ้นนั้นเกิดจากการแตกหน่อของไวรัสที่เหมาะสมที่สุดที่เยื่อหุ้มหลังซินแนปส์
การศึกษาเมื่อเร็วๆ นี้แสดงให้เห็นว่าปฏิสัมพันธ์ระหว่าง RV P และห่วงโซ่แสง dynein เชื่อมโยง RV RNP เข้ากับระบบการขนส่งเซลล์โฮสต์ จึงอำนวยความสะดวกในการขนส่งไวรัสย้อนกลับผ่านแอกซอน[ 48 ],[ 49 ] อย่างไรก็ตาม การติดเชื้อทางหลอดเลือดแดงส่วนปลายในหนูโตเต็มวัยแสดงให้เห็นว่าการลบโดเมนการจับ LC8 ของ RV P ออกไปไม่สามารถป้องกันการเข้าสู่ CNS ของไวรัส ซึ่งแสดงให้เห็นว่าโปรตีน RV ไม่มีส่วนเกี่ยวข้องโดยตรงในการแพร่กระจายของ RV ย้อนกลับผ่านแอกซอน[ 50 ]
- องค์ประกอบของไวรัสที่ควบคุมการจำลองของไวรัส
ต่างจากไวรัสอื่นๆ หลายชนิด เช่น ไวรัสไข้หวัดใหญ่ ความก่อโรคของไวรัส RV นั้นแปรผกผันกับอัตราการสังเคราะห์ RNA ของไวรัสและการผลิตอนุภาคไวรัสที่ติดเชื้อ การเปรียบเทียบระดับ mRNA ของไวรัสและ RNA ของจีโนมที่ผลิตโดยไวรัสไคเมอริกต่างๆ แสดงให้เห็นว่าการถอดรหัสและการจำลอง RNA ของไวรัสถูกควบคุมโดยปัจจัยหลายประการ รวมทั้ง RV M ซึ่งได้รับการระบุว่าเป็นปัจจัยที่ทำหน้าที่สลับจากการสังเคราะห์ mRNA ระดับสูงในช่วงแรกไปเป็นการสังเคราะห์ RNA ของจีโนม[ 51 ] นอกจากนี้ M จากไวรัสแรบโดทั้งหมดสามารถปิดการแสดงออกของยีนไวรัสได้โดยการจับกับ RNP ส่งผลให้เกิดโครงสร้างคล้ายกระดูกสันหลังที่มีความหนาแน่นสูงซึ่งไม่สามารถรองรับการสังเคราะห์ RNA ได้
เพื่อระบุองค์ประกอบของไวรัสอื่น ๆ ที่ควบคุมการก่อโรคโดยการควบคุมการจำลองแบบของไวรัส ลำดับปลาย 5' ของสายพันธุ์ SB ที่ก่อโรคได้สูงถูกแทนที่แบบขั้นตอนด้วยลำดับจากสายพันธุ์วัคซีน SN ที่ถูกทำให้ลดความรุนแรงลงอย่างมาก ส่งผลให้เกิดไวรัสรีคอมบิแนนท์ SB2 (ลำดับปลาย [TS] + L), SB3 (TS + L + pseudogene [Ψ]), SB4 (TS + L + Ψ + G) และ SB5 (TS + L + Ψ + G + M) การติดเชื้อเข้ากล้ามเนื้อด้วยไวรัส SB และ SN ของพ่อแม่และ RVs ไคเมอริก SB2, SB3, SB4 และ SB5 ทำให้มีอัตราการเสียชีวิตสูงสุดในหนูที่ติดเชื้อ SB และไม่มีอาการเจ็บป่วยหรือเสียชีวิตในหนูที่ติดเชื้อ SN การแทนที่ TS, L และ SB ด้วยองค์ประกอบที่สอดคล้องกันจาก SN ส่งผลให้อัตราการเจ็บป่วยและการเสียชีวิตลดลงเล็กน้อย และการแลกเปลี่ยน G หรือ G บวก M เพิ่มเติมช่วยลดความก่อโรคของไวรัสได้อย่างมากหรือขจัดไปได้หมดสิ้น
การจำแนกลักษณะทางฟีโนไทป์ของ RV ชนิดป่าและไคเมอริกเหล่านี้ในการเพาะเลี้ยงเนื้อเยื่อเผยให้เห็นว่าความก่อโรคของ RV ที่กำหนดนั้นมีความสัมพันธ์แบบผกผันกับความสามารถในการจำลองแบบในเซลล์ประสาท แม้ว่า SB จะจำลองแบบได้ในระดับที่ต่ำกว่า SN เกือบ 1,000 เท่า และการแทนที่ TS, L และใน SB ด้วยระดับ SN จะมีผลเพียงเล็กน้อยต่อจลนพลศาสตร์การเติบโตของไวรัส แต่การแทนที่ G หรือ G บวก M ของ SB เพิ่มเติมด้วยยีน SN ที่เกี่ยวข้องส่งผลให้การผลิตไวรัสเพิ่มขึ้น 1-log ซึ่งบ่งชี้ว่าจลนพลศาสตร์การจำลองแบบ RNA ของไวรัส รวมถึงการผลิตอนุภาคไวรัสส่วนใหญ่ถูกควบคุมโดยโปรตีน RV G ข้อสรุปนี้ได้รับการสนับสนุนจากข้อมูลที่ได้จากตัวแปร RV G ที่แตกต่างกันหนึ่งกรดอะมิโนในโปรตีน G ไวรัสพิษสุนัขบ้าสายพันธุ์ SPBNGAK 194 สร้างไทเตอร์ไวรัสในเซลล์ NA ที่ต่ำกว่าไทเตอร์ที่สร้างโดยไวรัสพิษสุนัขบ้าสายพันธุ์ SPBNGAN 194 ที่ไม่ก่อโรค 1 log และการวิเคราะห์ PCR แบบเรียลไทม์แสดงให้เห็นว่าอัตราการถอดรหัสและการจำลองแบบของ RNA ของไวรัสในเซลล์ NA ที่ติดเชื้อ SPBNGAK สูงกว่าในเซลล์ NA ที่ติดเชื้อ SPBNGAK 5 และ 10 เท่า[ 52 ] หลักฐานเพิ่มเติมสำหรับความสัมพันธ์แบบผกผันระหว่างความก่อโรคและอัตราการสังเคราะห์ RNA ของไวรัสและการผลิตอนุภาคไวรัสได้รับจากหนูที่ติดเชื้อไวรัสไคเมอริกรีคอมบิแนนท์ซึ่งยีน G และ M ของสายพันธุ์ SN ที่ลดความรุนแรงลงถูกแทนที่ด้วยยีนของสายพันธุ์ SB ที่ก่อโรคได้สูง การทดลองเหล่านี้เผยให้เห็นการเพิ่มขึ้นอย่างมีนัยสำคัญในความก่อโรคของสายพันธุ์ SN ดั้งเดิมที่มี RV G มากกว่าสายพันธุ์ SB ที่ก่อโรค ความก่อโรคเพิ่มขึ้นอีกเมื่อ G และ M จาก SB ถูกนำเข้าไปใน SN
การแทนที่ G หรือ M หรือทั้งสองอย่างใน SN ด้วยยีนที่สอดคล้องกันจาก SB เกี่ยวข้องกับการลดลงอย่างมีนัยสำคัญในอัตราการผลิตอนุภาคไวรัสเช่นเดียวกับอัตราการสังเคราะห์ RNA ของไวรัส ข้อมูลเหล่านี้บ่งชี้ว่าทั้ง G และ M มีบทบาทสำคัญในกระบวนการก่อโรค RV โดยควบคุมการจำลองแบบของไวรัส การค้นพบว่าการแทนที่ G หรือ G บวก M ใน SN ด้วย G หรือ G บวก M ของ SB ส่งผลให้การถอดรหัสและการจำลองแบบของ RNA ของไวรัสลดลงปานกลางถึงมากตามลำดับ ในขณะที่การแทนที่ M เพียงอย่างเดียวใน SN ด้วย M ของ SB ส่งผลให้การถอดรหัสและการจำลองแบบของ RNA ของไวรัสเพิ่มขึ้นอย่างมาก บ่งชี้ว่า RV G ยังมีหน้าที่ควบคุมที่สำคัญในกระบวนการถอดรหัส/การจำลองแบบของ RNA ของไวรัส ไม่ว่าจะโดยลำพังหรือผ่านปฏิสัมพันธ์กับโปรตีน M กลไกที่ยีน RV G ควบคุมการสังเคราะห์ RNA ของไวรัสยังไม่เป็นที่ทราบ ลำดับนิวคลีโอไทด์บางส่วนภายในยีน RV G เช่น ลำดับที่รวมโคดอนของ Arg333 และ Lys 194 ได้รับการระบุว่าเป็นเป้าหมายของไมโครอาร์เอ็นเอของเซลล์ มีการแสดงให้เห็นแล้วว่าการจดจำเป้าหมายโดยไมโครอาร์เอ็นเอของเซลล์สามารถส่งผลให้เกิดการควบคุมการจำลองแบบของไวรัสในเชิงบวกหรือเชิงลบ [ 53 ] การแทนที่ Arg 333 → Glu 333 หรือ Lys 194 → Ser 194 ภายในลำดับยีน RV G ส่งผลให้ลำดับเป้าหมายของไมโครอาร์เอ็นเอถูกยกเลิก ซึ่งส่งผลให้อัตราการสังเคราะห์ RNA ของไวรัสเพิ่มขึ้นอย่างมีนัยสำคัญ [Faber M, Thomas Jefferson University, PA, USA, ข้อมูลที่ไม่ได้เผยแพร่] ซึ่งแสดงให้เห็นว่าไมโครอาร์เอ็นเอของเซลล์โฮสต์ยังมีบทบาทสำคัญในการควบคุมการจำลองแบบของ RV อีกด้วย ซึ่งได้แสดงให้เห็นแล้วสำหรับไวรัส RNA อื่นๆ รวมทั้งไวรัส vesicular stomatitis และ HCV [ 54 ], [ 55 ]
การควบคุมการจำลองแบบของไวรัสดูเหมือนจะเป็นกลไกสำคัญอย่างหนึ่งที่เกี่ยวข้องกับการเกิดโรค RV เพื่อหลีกเลี่ยงการตอบสนองทางภูมิคุ้มกันและรักษาความสมบูรณ์ของเครือข่ายประสาท สายพันธุ์ RV ที่ก่อโรค (ไม่ใช่สายพันธุ์ที่ถูกทำให้ลดความรุนแรง) สามารถควบคุมอัตราการเจริญเติบโตของพวกมันได้ อัตราการจำลองแบบที่ต่ำลงน่าจะส่งผลดีต่อสายพันธุ์ RV ที่ก่อโรคโดยรักษาโครงสร้างประสาทที่ไวรัสเหล่านี้ใช้เข้าถึง CNS คำอธิบายอีกประการหนึ่งสำหรับอัตราการจำลองแบบที่ต่ำลงของ RV ที่ก่อโรคก็คือ เพื่อหลีกเลี่ยงการตรวจจับในระยะเริ่มต้นโดยระบบภูมิคุ้มกันของโฮสต์ ไวรัสจะรักษาระดับการแสดงออกของแอนติเจนในระดับต่ำ
ความสัมพันธ์ระหว่างการแสดงออกของ RV G, อะพอพโทซิส และการก่อโรค
เป็นที่ทราบกันดีว่าสายพันธุ์ไวรัสโรคพิษสุนัขบ้าที่แพร่ระบาดบนท้องถนนซึ่งก่อโรคได้มากกว่าสายพันธุ์ที่ดัดแปลงมาจากเนื้อเยื่อเพาะเลี้ยงอย่างมีนัยสำคัญนั้นแสดงระดับ G ที่จำกัดมากและไม่ทำให้เกิดอะพอพโทซิสจนกระทั่งช่วงปลายของวงจรการติดเชื้อ ซึ่งแสดงให้เห็นว่าความก่อโรคของสายพันธุ์ไวรัสเฉพาะนั้นมีความสัมพันธ์แบบผกผันกับการแสดงออกของ RV G และความสามารถในการทำให้เกิดอะพอพโทซิส[ 56 ] หลักฐานโดยตรงสำหรับความสัมพันธ์ระหว่างระดับการแสดงออกของ G และขอบเขตของอะพอพโทซิสนั้นได้มาจาก RV SPBNGA-GA แบบรีคอมบิแนนท์ ซึ่งมียีน G ที่เหมือนกันสองตัวและมีการแสดงออกของ RV G มากเกินไป[ 57 ] การศึกษาทางสัณฐานวิทยาของวัฒนธรรมของเซลล์ประสาทที่ติดเชื้อ RV แบบรีคอมบิแนนท์นี้แสดงให้เห็นว่าการตายของเซลล์เพิ่มขึ้นอย่างมีนัยสำคัญควบคู่ไปกับการแสดงออกของ RV G มากเกินไป และอะพอพโทซิสเป็นกลไกหลักที่เกี่ยวข้องกับการเสียชีวิตที่เกิดจาก RV G โดยเฉพาะอย่างยิ่ง การลดลงของการย้อม F-actin หลังจากการติดเชื้อ SPBNGA-GA นั้นสอดคล้องกับการสลายของเส้นใยแอคตินที่เกิดจากอะพอพโทซิส นอกจากนี้ จำนวนนิวเคลียส TUNEL-positive ในนิวรอนที่ติดเชื้อ SPBNGA-GA เพิ่มขึ้นอย่างมีนัยสำคัญเมื่อเทียบกับในนิวรอนที่ไม่ติดเชื้อและที่ติดเชื้อ SPBNGA อย่างไรก็ตาม กลไกที่ยีน RV G ทำหน้าที่เป็นตัวกลางในกระบวนการส่งสัญญาณอะพอพโทซิสยังคงไม่เป็นที่ทราบแน่ชัด มีข้อเสนอแนะว่าการแสดงออกของ RV G ที่เกินเกณฑ์หนึ่งจะทำลายเยื่อหุ้มเซลล์อย่างรุนแรง มีความเป็นไปได้สูงที่เซลล์อะพอพโทซิสจะไม่ถูกกำจัดอย่างรวดเร็วใน CNS และด้วยเหตุนี้จึงเกิดภาวะเนื้อตายทุติยภูมิ [ 58 ] ในทางกลับกัน การติดเชื้อ RV และโดยเฉพาะอย่างยิ่งการแสดงออกของโปรตีน RV G มากเกินไปสามารถนำไปสู่ไพโรพโทซิส ซึ่งเป็นเส้นทางการตายของเซลล์ที่คล้ายกับอะพอพโทซิส ซึ่งต่างจากอะพอพโทซิสตรงที่เกี่ยวข้องกับการกระตุ้นของคาสเปส 1 และด้วยเหตุนี้จึงนำไปสู่ภาวะเนื้อตาย [ 59 ] ระดับของภาวะเนื้อตายหรือไพโรพโทซิสที่เกิดจากการติดเชื้อ RV อาจมีบทบาทสำคัญในการเหนี่ยวนำภูมิคุ้มกันต่อต้านไวรัส ในขณะที่เซลล์ที่เกิดอะพอพโทซิสยังคงความสมบูรณ์ของเยื่อหุ้มเซลล์ไว้และไม่กระตุ้นการตอบสนองภูมิคุ้มกันโดยกำเนิด เซลล์ที่ตายจะกลายเป็นเซลล์ที่สามารถซึมผ่านได้และหลั่งสารเสริมฤทธิ์ภายในเซลล์ซึ่งสามารถกระตุ้นการตอบสนองภูมิคุ้มกันโดยกำเนิดที่แข็งแกร่งได้ [ 60 ]
เนื่องจากระดับของอะพอพโทซิส/เนื้อตายสัมพันธ์กับภูมิคุ้มกัน RV จึงมีการเสนอว่าผลการกระตุ้นภูมิคุ้มกันของเซลล์อะพอพโทซิส/เนื้อตายน่าจะมีส่วนช่วยในการสร้างการตอบสนองภูมิคุ้มกันป้องกัน ดังนั้น การควบคุมการแสดงออกของ RV G น่าจะเป็นปัจจัยสำคัญอย่างยิ่งในการเกิดโรคพิษสุนัขบ้า เนื่องจากเป็นวิธีการสำหรับการอยู่รอดและการแพร่กระจายของตัวแปร RV ที่ก่อโรคในระบบประสาทโดยไม่ก่อให้เกิดความเสียหายต่อเซลล์ประสาทโดยตรง และกระตุ้นการตอบสนองภูมิคุ้มกันป้องกันที่จะป้องกันการติดเชื้อ
การแสดงออกของ RV G อาจถูกควบคุมที่ระดับการสังเคราะห์ RNA ระดับหลังการแปล หรือทั้งสองระดับ ระดับของ RV G ที่แสดงออกโดยตัวแปรไคเมอริก RV ที่แตกต่างกันได้รับการแสดงให้เห็นว่าสะท้อนให้เห็นโดยอัตราการสังเคราะห์ RNA ของไวรัส ซึ่งแสดงให้เห็นว่าการควบคุมที่แตกต่างกันของการแสดงออกของ RV G โดยตัวแปรเหล่านี้เป็นผลมาจากการเปลี่ยนแปลงในอัตราการถอดรหัส mRNA ของไวรัส เช่นเดียวกับอัตราการถอดรหัส RNA ของไวรัส ปริมาณของ RV G ที่แสดงออกโดยตัวแปรเหล่านี้มีความสัมพันธ์แบบผกผันกับความก่อโรคของไวรัส ในทางกลับกัน การติดเชื้อของเซลล์ประสาทหลักด้วยตัวแปร RV ที่มีความรุนแรงน้อยกว่า CVS-B2c ส่งผลให้ระดับโปรตีน G สูงขึ้นสี่เท่าเมื่อเทียบกับการติดเชื้อด้วยตัวแปรที่มีความรุนแรงสูง CVS-N2c แม้ว่าจะมีการสังเคราะห์ mRNA ของ G ในระดับที่ใกล้เคียงกันในทั้งสองการติดเชื้อก็ตาม การทดลองแบบพัลส์เชสแสดงให้เห็นว่าระดับโปรตีนจีที่สูงขึ้นในเซลล์ประสาทที่ติดเชื้อ CVS-B2c ส่วนใหญ่เป็นผลมาจากอัตราการย่อยสลายของโปรตีนจี CVS-B2c ที่ต่ำกว่าเมื่อเทียบกับโปรตีนจี CVS-N2c อย่างไรก็ตาม กลไกที่นำไปสู่การสลายตัวของโปรตีโอไลติกของโปรตีนจี CVS-N2c ยังคงต้องศึกษากันต่อไป
อาการ โรคพิษสุนัขบ้า
ระยะฟักตัวของโรคพิษสุนัขบ้าโดยเฉลี่ยอยู่ที่ 30-90 วัน หากติดเชื้อรุนแรงผ่านบาดแผลขนาดใหญ่ที่ศีรษะและใบหน้า อาจลดระยะฟักตัวลงเหลือ 12 วัน ในบางกรณีอาจใช้เวลานานถึง 1 ปีหรือมากกว่านั้น
การเปลี่ยนแปลงของโรคมี 3 ระยะตามลำดับอย่างเคร่งครัด คือ ระยะเริ่มแรก ระยะกำเริบ ระยะอัมพาต
ระยะเริ่มต้นเริ่มต้นด้วยการปรากฏของอาการปวดหรือดึงที่บริเวณที่ถูกกัดเช่นเดียวกับความเจ็บปวดตามเส้นประสาท ในบริเวณแผลเป็นอาจรู้สึกแสบร้อนคันบางครั้งมีรอยแดงและบวม ผู้ป่วยจะรู้สึกไม่สบายโดยทั่วไปปวดศีรษะคลื่นไส้ อาเจียนอุณหภูมิร่างกายเพิ่มขึ้นเป็น 37.5-38 ° C และอาการของโรคจิตที่ค่อยๆ แย่ลง ได้แก่ การกระตุ้นปฏิกิริยาตอบสนองที่เพิ่มขึ้น ความรู้สึกวิตกกังวลกลัวเศร้าโศกโดยไม่สามารถอธิบายได้ บ่อยครั้งที่ผู้ป่วยซึมเศร้ายับยั้งชั่งใจเก็บตัวปฏิเสธที่จะกินอาหารนอนหลับไม่ดีบ่นถึงความคิดที่มืดมนและฝันร้าย ระยะเริ่มต้นจะกินเวลา 2-3 วันบางครั้งยาวถึง 7 วัน เมื่อสิ้นสุดระยะเวลานี้อาจมีการโจมตีของความวิตกกังวลพร้อมกับหายใจลำบากในระยะสั้นรู้สึกแน่นหน้าอกพร้อมกับหัวใจเต้นเร็วและอัตราการหายใจที่เพิ่มขึ้น
ระยะตื่นเต้นจะมีลักษณะอาการกลัวน้ำ เมื่อพยายามดื่มน้ำ แล้วเห็นน้ำหรือนึกขึ้นได้ ผู้ป่วยจะมีอาการกระตุกของคอหอยและกล่องเสียง โดยจะโยนแก้วน้ำทิ้งพร้อมร้องกรี๊ด โยนมือสั่นไปข้างหน้า เงยหัวและลำตัวไปข้างหลัง คอจะยืดออก แสยะยิ้มอย่างเจ็บปวด ทำให้หน้าบูดบึ้ง ซึ่งจะกลายเป็นสีน้ำเงินเนื่องจากกล้ามเนื้อหายใจกระตุก ตาโปน แสดงความกลัว ขอความช่วยเหลือ รูม่านตาขยาย หายใจเข้าลำบาก เมื่ออาการกำเริบ อาจเกิดภาวะหัวใจหยุดเต้นและหายใจไม่ออก อาการจะคงอยู่หลายวินาที หลังจากนั้น อาการของผู้ป่วยดูเหมือนจะดีขึ้น ต่อมาอาจเกิดอาการกระตุกของกล้ามเนื้อกล่องเสียงและคอหอยได้แม้จะเกิดจากการเคลื่อนไหวของอากาศ (aerophobia) แสงสว่างจ้า (photophobia) หรือเสียงดัง (acousticophobia) อาการกำเริบจะมาพร้อมกับอาการจิตเภท ซึ่งผู้ป่วยจะแสดงพฤติกรรมเหมือนคนบ้า จิตสำนึกจะมัวหมองในระหว่างที่มีอาการ แต่จะดีขึ้นในช่วงที่มีอาการชัก ในช่วงเวลาของอาการกำเริบ เนื่องจากระบบประสาทซิมพาเทติกมีการทำงานเพิ่มขึ้น ผู้ป่วยจะมีน้ำลายไหลมากขึ้นอย่างรวดเร็ว (ไซอาโลเรีย) โดยไม่สามารถกลืนน้ำลายได้เนื่องจากกล้ามเนื้อคอหอยกระตุก ผู้ป่วยจะพ่นน้ำลายออกมา ผู้ป่วยบางรายอาจมีอาการเยื่อหุ้มสมองอักเสบและอาการกระตุกของกล้ามเนื้อคอ และมักเกิดอาการชัก ในกรณีนี้ น้ำไขสันหลังอาจไม่เปลี่ยนแปลง แต่ในผู้ป่วยบางราย ความเข้มข้นของโปรตีนอาจเพิ่มขึ้น และจำนวนเซลล์อาจเพิ่มขึ้นเนื่องจากลิมโฟไซต์
หากไม่ได้รับการรักษาอย่างเหมาะสม อาการขาดน้ำจะเพิ่มขึ้น ใบหน้าคมขึ้น และน้ำหนักตัวลดลง อุณหภูมิร่างกายสูงขึ้น อาจเกิดอาการชักได้ ระยะการกำเริบของโรคใช้เวลาประมาณ 2-3 วัน ในบางกรณีอาจนานถึง 4-5 วัน มักเสียชีวิตระหว่างที่มีอาการ และผู้ป่วยบางรายอาจรอดชีวิตจนถึงระยะที่ 3 ของโรค
ในช่วงที่เป็นอัมพาต ผู้ป่วยจะสงบลง อาการกลัวน้ำจะหยุดลง ผู้ป่วยสามารถดื่มและกลืนอาหารได้ มีสติสัมปชัญญะแจ่มใส อย่างไรก็ตาม แม้จะดูสบายดี แต่ความเฉื่อยชา ความเฉยเมย ความซึมเศร้าเพิ่มขึ้น แขนขาเป็นอัมพาต ความผิดปกติของอุ้งเชิงกราน อัมพาตของเส้นประสาทสมองก็ปรากฏขึ้นในไม่ช้า อุณหภูมิร่างกายจะสูงขึ้นถึง 42-43 °C ความดันเลือดแดงลดลง และภายในสิ้นวันแรก อาจเสียชีวิตจากอัมพาตของศูนย์หัวใจและหลอดเลือดและระบบทางเดินหายใจ
ตรวจพบภาวะเม็ดเลือดขาวชนิดนิวโทรฟิลเพิ่มขึ้น ฮีโมโกลบิน เม็ดเลือดแดง และค่าฮีมาโตคริตในเลือดส่วนปลาย
สิ่งที่รบกวนคุณ?
รูปแบบ
ในทางคลินิกจะแบ่งรูปแบบปกติและผิดปกติได้ รูปแบบผิดปกติได้แก่ ทุกกรณีที่ไม่มีการตื่นตัวหรือกลัวน้ำ รูปแบบผิดปกติได้แก่ ภาวะหลอดเลือดสมองอุดตัน ภาวะสมองน้อย ภาวะเยื่อหุ้มสมองอักเสบ เป็นต้น
การวินิจฉัย โรคพิษสุนัขบ้า
การตรวจหาแอนติเจนโรคพิษสุนัขบ้า แอนติบอดี อาร์เอ็นเอของไวรัส หรือการแยกไวรัสช่วยให้วินิจฉัยโรคพิษสุนัขบ้าได้ เนื่องจากการทดสอบแบบรายบุคคลอาจให้ผลลบในผู้ป่วยโรคพิษสุนัขบ้า ดังนั้นบางครั้งอาจจำเป็นต้องเก็บตัวอย่างซีรั่มเพื่อตรวจหาแอนติบอดีต่อโรคพิษสุนัขบ้า เก็บตัวอย่างน้ำลายเพื่อเพาะเชื้อไวรัส และเก็บตัวอย่างชิ้นเนื้อผิวหนังเพื่อทดสอบภูมิคุ้มกันฟลูออเรสเซนซ์โดยตรงสำหรับแอนติเจนไวรัส โดยเฉพาะอย่างยิ่งเมื่อสงสัยว่าเป็นโรคพิษสุนัขบ้าอย่างมาก
วิธีที่รวดเร็วที่สุดวิธีหนึ่งในการวินิจฉัยโรคพิษสุนัขบ้าก่อนตายในมนุษย์คือการทดสอบภูมิคุ้มกันฟลูออเรสเซนซ์โดยตรงกับชิ้นเนื้อผิวหนังบริเวณท้ายทอยเพื่อตรวจหาแอนติเจนของโรคพิษสุนัขบ้า การทดสอบภูมิคุ้มกันฟลูออเรสเซนซ์โดยตรงเป็นวิธีที่มีความไวและจำเพาะที่สุดในการตรวจหาแอนติเจนของโรคพิษสุนัขบ้าในผิวหนังและเนื้อเยื่อสดอื่นๆ (เช่น การตรวจชิ้นเนื้อสมอง) แม้ว่าบางครั้งผลลัพธ์อาจเป็นลบในระยะเริ่มต้นของโรคก็ตาม หากไม่มีเนื้อเยื่อสด การย่อยด้วยเอนไซม์ของเนื้อเยื่อที่ตรึงไว้อาจเพิ่มการตอบสนองของการทดสอบภูมิคุ้มกันฟลูออเรสเซนซ์ อย่างไรก็ตาม ความไวอาจต่ำจนไม่สามารถยอมรับได้
การวินิจฉัยสามารถทำได้เช่นกันหากแยกไวรัสจากน้ำลายหลังจากฉีดเซลล์นิวโรบลาสโตมาหรือสัตว์ฟันแทะในห้องทดลอง ซึ่งโดยปกติจะได้ผลดีที่สุดในช่วง 2-3 สัปดาห์แรกของการเจ็บป่วย การตรวจหาแอนติบอดีที่ทำลายไวรัสโรคพิษสุนัขบ้า ซึ่งมักทำโดยการทดสอบการยับยั้งโฟกัสฟลูออเรสเซนต์อย่างรวดเร็ว (Rapid Fluorescent Focus Inhibition Test หรือ RFFIT) ในซีรัมของบุคคลที่ไม่ได้รับการฉีดวัคซีนก็ถือเป็นการวินิจฉัยโรคได้เช่นกัน การมีแอนติบอดีในน้ำไขสันหลังจะยืนยันการวินิจฉัยได้ แต่แอนติบอดีเหล่านี้อาจปรากฏขึ้นช้ากว่าแอนติบอดีในซีรัม 2-3 วัน ดังนั้นจึงอาจมีประโยชน์น้อยกว่าในระยะเริ่มต้นของโรค แม้ว่าโดยทั่วไปแล้วการตอบสนองทางเซรุ่มหลังการฉีดวัคซีนจะไม่สามารถแยกแยะได้จากการตอบสนองทางเซรุ่มที่เกิดจากโรค แต่การฉีดวัคซีนมักจะไม่ก่อให้เกิดแอนติบอดีต่อน้ำไขสันหลัง
ในช่วง 25 ปีที่ผ่านมา มีการบันทึกกรณีโรคพิษสุนัขบ้าที่ "หาย" ไปแล้วเพียง 7 กรณีเท่านั้น แม้ว่าจะไม่ได้แยกเชื้อไวรัสพิษสุนัขบ้าจากผู้ป่วยรายใดเลยก็ตาม แต่ระดับแอนติบอดีที่ทำลายพิษสุนัขบ้าในตัวอย่างซีรั่มที่สูงและการมีแอนติบอดีที่ทำลายฤทธิ์ในน้ำไขสันหลังก็สนับสนุนการวินิจฉัยโรคนี้ได้เป็นอย่างดี
สิ่งที่ต้องตรวจสอบ?
ต้องการทดสอบอะไรบ้าง?
การวินิจฉัยที่แตกต่างกัน
การวินิจฉัยโรคพิษสุนัขบ้าในคนมักจะทำโดยอาศัยข้อมูลทางระบาดวิทยาและทางคลินิก และได้รับการยืนยันในห้องปฏิบัติการ การวินิจฉัยจะตรงไปตรงมาหากมีประวัติการถูกสัตว์กัดและมีอาการและสัญญาณครบถ้วน มิฉะนั้น จำเป็นต้องประเมินลักษณะทางระบาดวิทยาและทางคลินิกของกรณีที่ไม่ค่อยพบบ่อยอย่างระมัดระวังแต่รวดเร็วก่อนทำการทดสอบในห้องปฏิบัติการเฉพาะ ผู้ป่วยที่มีอาการทางระบบประสาทหรือโรคสมองอักเสบที่ไม่ทราบสาเหตุควรได้รับการสอบถามเกี่ยวกับความเป็นไปได้ในการสัมผัสกับสัตว์ในพื้นที่ที่มีโรคพิษสุนัขบ้าระบาดภายในหรือภายนอกประเทศที่พำนักอาศัย การไม่สงสัยว่าเป็นโรคพิษสุนัขบ้าในผู้เสียชีวิตหลายรายในสหรัฐอเมริกาเมื่อเร็วๆ นี้อาจเกิดจากการขาดประวัติการสัมผัสโรคอย่างระมัดระวัง
ในช่วงเริ่มต้นของโรค โรคพิษสุนัขบ้าสามารถเลียนแบบโรคติดเชื้อและไม่ติดเชื้อได้หลายชนิด โรคสมองอักเสบชนิดอื่นๆ เช่น โรคที่เกิดจากไวรัสเริมและไวรัสอาร์โบ มีลักษณะคล้ายกับโรคพิษสุนัขบ้า โรคติดเชื้อชนิดอื่นๆ ยังสามารถเลียนแบบโรคพิษสุนัขบ้าได้ เช่น บาดทะยัก มาเลเรียในสมอง ริคเก็ตต์เซีย และไข้รากสาด โรคติดเชื้ออัมพาตที่อาจสับสนกับโรคพิษสุนัขบ้าได้ ได้แก่ โรคโปลิโอ โรคโบทูลิซึม และโรคสมองอักเสบจากไวรัสเริมในลิงชนิดบี
โรคไม่ติดเชื้อที่อาจสับสนกับโรคพิษสุนัขบ้าได้ ได้แก่ กลุ่มอาการทางระบบประสาทหลายชนิด โดยเฉพาะโรคเส้นประสาทอักเสบเฉียบพลัน (กลุ่มอาการกีแลง-บาร์เร) รวมถึงภาวะสมองและไขสันหลังอักเสบจากการแพ้หลังฉีดวัคซีนซึ่งเกิดจากการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าที่เนื้อเยื่อประสาท พิษจากยาหรืออาการมึนเมาจากยา อาการถอนแอลกอฮอล์ โรคพอร์ฟิเรียเฉียบพลัน และโรคกลัวพิษสุนัขบ้า กลุ่มอาการกีแลง-บาร์เรอาจถูกเข้าใจผิดว่าเป็นโรคพิษสุนัขบ้าแบบอัมพาต และในทางกลับกัน
ใครจะติดต่อได้บ้าง?
การรักษา โรคพิษสุนัขบ้า
ยังไม่มีการพัฒนาวิธีการรักษาโรคพิษสุนัขบ้า การให้อิมมูโนโกลบูลินและอินเตอร์เฟอรอนเม็ดเลือดขาวเฉพาะสำหรับป้องกันโรคพิษสุนัขบ้าในปริมาณมากไม่ได้ผล จึงต้องรักษาตามอาการเพื่อบรรเทาความทุกข์ทรมานของผู้ป่วย เพื่อจุดประสงค์นี้ ผู้ป่วยจะถูกจัดให้อยู่ในห้องหรือห้องแยกกัน มีการสร้างระบบป้องกันที่จำกัดอิทธิพลของสภาพแวดล้อมภายนอก (ลดเสียง แสงสว่าง การไหลเวียนของอากาศ) เพื่อลดความตื่นเต้นของระบบประสาทส่วนกลาง แพทย์จึงสั่งจ่ายยานอนหลับ ยากันชัก และยาแก้ปวด และปรับสมดุลของน้ำให้เป็นปกติ
ในระยะอัมพาต แพทย์จะสั่งจ่ายยาที่กระตุ้นการทำงานของระบบหัวใจและหลอดเลือดและระบบทางเดินหายใจ แนะนำให้ใช้ออกซิเจนแรงดันสูง อุณหภูมิสมองต่ำ การหายใจด้วยเครื่องช่วยหายใจแบบควบคุมโดยให้ผู้ป่วยได้รับการดูแลอย่างครบถ้วน อย่างไรก็ตาม วิธีการรักษาทั้งหมดแทบไม่มีประสิทธิผล ในกรณีที่ดีที่สุด อาจยืดอายุผู้ป่วยออกไปได้หลายเดือน ผลลัพธ์ที่ไม่พึงประสงค์นั้นกำหนดไว้ล่วงหน้าโดยความรุนแรงของความเสียหายต่อก้านสมองจากการทำลายศูนย์กลางที่สำคัญ
การป้องกัน
การพัฒนาวัคซีนป้องกันโรคพิษสุนัขบ้าครั้งแรกโดยปาสเตอร์ในปี 1885 เป็นการเปิดศักราชใหม่แห่งการควบคุมโรคพิษสุนัขบ้าที่มีประสิทธิภาพมากขึ้น ปัจจุบัน แม้ว่าอัตราการเสียชีวิตจากโรคพิษสุนัขบ้าในมนุษย์จะเกือบ 100% แต่โรคนี้ป้องกันได้อย่างสมบูรณ์ด้วยการฉีดวัคซีนก่อนและ/หรือหลังการสัมผัสโรค แม้ว่าปาสเตอร์และเพื่อนร่วมงานของเขาจะริเริ่มการฉีดวัคซีนให้กับสุนัขเอกชนในปารีส แต่การฉีดวัคซีนให้กับสุนัขจำนวนมากครั้งแรกนั้นดำเนินการในช่วงต้นทศวรรษปี 1920 ในญี่ปุ่น ซึ่งถือเป็นโครงการควบคุมโรคพิษสุนัขบ้าแห่งชาติครั้งแรก การฉีดวัคซีนให้สัตว์ป่าทางปาก ซึ่งพัฒนาขึ้นครั้งแรกในช่วงทศวรรษปี 1970 ได้รับการพิสูจน์ซ้ำแล้วซ้ำเล่าว่าสามารถควบคุมโรคได้อย่างมีประสิทธิภาพในสัตว์ที่เป็นแหล่งอาศัยหลักบนบก เช่น จิ้งจอก แรคคูน และสกั๊งค์[ 68 ] การฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าอย่างต่อเนื่องให้กับสัตว์ที่เป็นแหล่งอาศัยที่อัตราครอบคลุม 70% ขึ้นไป จะกำจัดไวรัส RABV จากสัตว์ที่เป็นแหล่งอาศัยในที่สุด และป้องกันการแพร่กระจายของไวรัสไปยังสัตว์ที่เป็นแหล่งอาศัยอื่นๆ [ 69 ]
ข้อมูลทางวิวัฒนาการบ่งชี้ว่าไวรัสลิสซาได้แพร่ระบาดในค้างคาวก่อนจะแพร่ระบาดในสัตว์เลี้ยงลูกด้วยนมบนบก และไวรัสลิสซาส่วนใหญ่ รวมถึงไวรัส RABV ยังคงแพร่ระบาดในค้างคาวหลายสายพันธุ์ทั่วโลก[ 70 ] อย่างไรก็ตาม วิธีการที่มีประสิทธิภาพในการป้องกันการแพร่ระบาดไวรัส RABV ในค้างคาวยังคงไม่ชัดเจน ทำให้ไม่สามารถกำจัดโรคพิษสุนัขบ้าได้หมดในเวลานี้ อย่างไรก็ตาม แม้ว่าจะสัมผัสกับไวรัส RABV ผ่านการถูกสัตว์เลี้ยงลูกด้วยนมที่ติดเชื้อพิษสุนัขบ้ากัด การป้องกันหลังการสัมผัสโรคที่ปลอดภัยและมีประสิทธิภาพ (PEP รวมถึงการทำความสะอาดแผล ภูมิคุ้มกันโรคพิษสุนัขบ้า และการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้า) สามารถป้องกันมนุษย์จากการติดเชื้อพิษสุนัขบ้าได้ หากได้รับการรักษาอย่างทันท่วงทีและปฏิบัติตามคำแนะนำขององค์การอนามัยโลก (WHO)
วิธีการป้องกันการเสียชีวิตของมนุษย์ทั้งสองวิธีนี้—วิธีหนึ่งคือการฉีดวัคซีนให้กับผู้ที่สัมผัสโรค และอีกวิธีหนึ่งคือการฉีดวัคซีนให้กับสุนัขในปริมาณที่เพียงพอเพื่อหยุดวงจรการแพร่เชื้อที่ต้นเหตุ—ถือเป็นรากฐานของแนวทาง "สุขภาพเดียว" ในการป้องกันและควบคุมโรคพิษสุนัขบ้าในสุนัข วิธีการป้องกันการเสียชีวิตของมนุษย์สองวิธีนี้ถือเป็นทางเลือกที่แยกจากกัน: กลยุทธ์ A ซึ่งให้ยา PEP แก่ผู้คน และกลยุทธ์ B ซึ่งให้สุนัขฉีดวัคซีน หรือเป็นส่วนประกอบของกลยุทธ์ A + B ร่วมกันในการวิเคราะห์ต้นทุนที่เป็นไปได้ของกลยุทธ์ทางเลือก[ 71 ]
ประเทศต่างๆ เช่น ประเทศไทย ประสบความสำเร็จอย่างสูงในการป้องกันการเสียชีวิตของมนุษย์ด้วยการใช้ยา PEP แต่ยังพบว่าความต้องการและต้นทุนที่เกี่ยวข้องกับการใช้ยา PEP เพียงอย่างเดียวมีเพิ่มมากขึ้นด้วย [ 72 ] ตัวอย่างเช่น เมื่อเปรียบเทียบกับสถานการณ์ในปี 1991 พบว่าในปี 2003 มีผู้คนจำนวนมากขึ้นถึงสี่เท่า (มากกว่า 400,000 คน) ที่ต้องการยา PEP ข้อมูลล่าสุดแสดงให้เห็นว่าสาธารณรัฐประชาชนจีน ซึ่งฉีดวัคซีนให้กับผู้คน 15 ล้านคนต่อปีหลังจากสัมผัสโรคพิษสุนัขบ้า ใช้จ่ายประมาณ 650 ล้านดอลลาร์สหรัฐต่อปีสำหรับยา PEP เพียงอย่างเดียว [ 73 ]
แนวทางที่ยั่งยืนกว่ามากคือการป้องกันการแพร่กระจายของการติดเชื้อที่แหล่งกำเนิดในประชากรสัตว์ ขณะเดียวกันก็เพิ่มการเข้าถึงยา PEP สำหรับผู้ป่วยที่สัมผัสโรคเมื่อจำเป็น หากมีเจตจำนงทางการเมืองและเงินทุนเพียงพอในการควบคุมโรคพิษสุนัขบ้าในสุนัข ก็สามารถกำจัดการเสียชีวิตได้ การใช้วัคซีนสำหรับสุนัขอย่างแพร่หลายทำให้โรคพิษสุนัขบ้าในสุนัขถูกกำจัดไปในหลายประเทศ รวมทั้งมาเลเซียในปี 1954 [ 74 ] ญี่ปุ่นในปี 1956 ไต้หวันในปี 1961 สิงคโปร์ และโดยเฉพาะอย่างยิ่งทั่วทั้งยุโรปตะวันตก (มีการตรวจสอบใน Rupprecht et al, King et al และ Gongal และ Wright) [ 75 ]
Использованная литература


 [
[