ผู้เชี่ยวชาญทางการแพทย์ของบทความ
สิ่งตีพิมพ์ใหม่
มาลาเรีย
Last reviewed: 04.07.2025

เนื้อหา iLive ทั้งหมดได้รับการตรวจสอบทางการแพทย์หรือตรวจสอบข้อเท็จจริงเพื่อให้แน่ใจว่ามีความถูกต้องตามจริงมากที่สุดเท่าที่จะเป็นไปได้
เรามีแนวทางการจัดหาที่เข้มงวดและมีการเชื่อมโยงไปยังเว็บไซต์สื่อที่มีชื่อเสียงสถาบันการวิจัยทางวิชาการและเมื่อใดก็ตามที่เป็นไปได้ โปรดทราบว่าตัวเลขในวงเล็บ ([1], [2], ฯลฯ ) เป็นลิงก์ที่คลิกได้เพื่อการศึกษาเหล่านี้
หากคุณรู้สึกว่าเนื้อหาใด ๆ ของเราไม่ถูกต้องล้าสมัยหรือมีข้อสงสัยอื่น ๆ โปรดเลือกแล้วกด Ctrl + Enter
มาเลเรีย (ภาษาอังกฤษ malaria; ภาษาฝรั่งเศส paludisme) เป็นโรคติดเชื้อโปรโตซัวเฉียบพลันที่ติดต่อได้จากมนุษย์ซึ่งมีกลไกการติดเชื้อที่สามารถแพร่กระจายได้ มีลักษณะเด่นคือ อาการมึนเมาที่รุนแรง มีอาการเป็นวัฏจักรโดยมีอาการไข้สลับกับไม่มีไข้เป็นระยะ ม้ามและตับโต มีอาการโลหิตจางจากเม็ดเลือดแดงแตกซึ่งอาการจะค่อย ๆ แย่ลง และโรคจะกลับมาเป็นอีก
ระบาดวิทยา
แหล่งที่มาของเชื้อก่อโรคคือผู้ป่วยหรือผู้ที่เป็นพาหะของปรสิตซึ่งมีเซลล์สืบพันธุ์เพศผู้อยู่ในเลือด มาเลเรียเป็นโรคติดเชื้อที่ติดต่อได้จากการถูกยุงกัด เซลล์สืบพันธุ์เพศผู้ของ P. vivax, P. ovale และ P. malariae พบได้ในเลือดในช่วงวันแรกของโรค จำนวนเซลล์เหล่านี้จะเพิ่มขึ้นหลังจากเกิดอาการ erythrocytic schizogony หลายรอบ เมื่อติดเชื้อ P. falciparum บุคคลนั้นจะกลายเป็นแหล่งของการติดเชื้อ 10-12 วันหลังจากเริ่มมีปรสิตในเลือด และอาจคงอยู่ต่อไปได้อีก 2 เดือนหรือมากกว่านั้น
โรคมาลาเรียมีกลไกการแพร่กระจายเชื้อได้หลากหลาย:
กลไกการส่งผ่าน (ยุงกัด)
กลไกนี้ถือเป็นกลไกหลักที่ช่วยให้พลาสโมเดียดำรงอยู่ได้ในฐานะสปีชีส์ทางชีววิทยา แหล่งที่มาของการติดเชื้อคือบุคคล (ป่วยด้วยมาเลเรียหรือเป็นพาหะของปรสิต) ซึ่งมีเซลล์สืบพันธุ์เพศผู้และเพศเมียของปรสิตอยู่ในเลือด ผู้ที่พาหะของมาเลเรียคือยุงตัวเมียในสกุล Anopheles เท่านั้น
ในกระเพาะของยุง ซึ่งเป็นที่ที่เซลล์สืบพันธุ์เพศผู้และเพศเมียภายในเม็ดเลือดแดงจะเข้าสู่กระเพาะพร้อมกับเลือด เซลล์สืบพันธุ์เพศผู้และเพศเมียจะเจริญเติบโตต่อไป (หลังจากเม็ดเลือดแดงแตกสลาย) หลอมรวมและแบ่งตัวหลายครั้งโดยเกิดการสร้างสปอโรซอยต์ ซึ่งจะสะสมอยู่ในต่อมน้ำลายของยุง ปรสิตที่มีลักษณะไม่อาศัยเพศ (โทรโฟซอยต์ ชิซอนต์) จะตายเมื่อเข้าไปในกระเพาะของยุง
ดังนั้นในร่างกายมนุษย์ จึงเกิดกระบวนการพัฒนาปรสิตแบบไม่อาศัยเพศ (schizogony) โดยมีการก่อตัวและสะสมของเซลล์สืบพันธุ์เพศผู้ และในร่างกายยุง ก็เกิดกระบวนการพัฒนาแบบอาศัยเพศ (sporogony) โดยมีการรวมตัวของเซลล์สืบพันธุ์เพศผู้และเพศเมียพร้อมกับการพัฒนาต่อไป และเกิดการสร้างสปอโรซอยต์
 [ 4 ], [ 5 ], [ 6 ], [ 7 ], [ 8 ], [ 9 ]
[ 4 ], [ 5 ], [ 6 ], [ 7 ], [ 8 ], [ 9 ]
กลไกการส่งผ่านแนวตั้ง
กลไกการถ่ายทอดทางแนวตั้ง (จากแม่สู่ทารกในครรภ์) หรือจากแม่สู่ทารกแรกเกิด (ระหว่างการคลอดบุตร - กลไกทางหลอดเลือด) สำหรับการถ่ายทอดทางแนวตั้ง ทารกในครรภ์จะไม่ค่อยได้รับเชื้อผ่านรก แต่การติดเชื้อมักเกิดขึ้นระหว่างการคลอดบุตรเมื่อเลือดของมารดาจำนวนหนึ่งเข้าสู่กระแสเลือดของทารกแรกเกิด ซึ่งในเม็ดเลือดแดงจะมีปรสิตในรูปแบบที่ไม่อาศัยเพศอยู่
กลไกการส่งผ่านทางเส้นเลือด
กลไกการติดเชื้อทางหลอดเลือดทำให้เกิดการพัฒนาของมาเลเรียที่เรียกว่า schizont ซึ่งเกิดขึ้นระหว่างการถ่ายเลือดหรือในกรณีที่ไม่บ่อยนัก เกิดขึ้นระหว่างการไม่ติดเชื้อระหว่างการฉีดยา (ตัวอย่างเช่น ในกลุ่มผู้ติดยาที่ใช้เข็มฉีดยาเดียวกัน) ในกรณีของการติดเชื้อระหว่างการถ่ายเลือด แหล่งที่มาของการติดเชื้อคือพาหะของปรสิตที่บริจาค ซึ่งมักมีปรสิตแฝงอยู่ (จำนวนปรสิตน้อยกว่าห้าตัวในเลือด 1 ไมโครลิตร) ดังนั้น ในภูมิภาคต่างๆ ของโลกที่มีมาเลเรียระบาด จึงจำเป็นต้องใช้วิธีทางปรสิตวิทยา (การตรวจหาปรสิตในสารละลายข้นและเลือด) วิธีทางภูมิคุ้มกัน (ภูมิคุ้มกันวิทยา) ในการวินิจฉัยมาเลเรียในห้องปฏิบัติการ (RNIF, ELISA เป็นต้น) เพื่อควบคุมเลือดของผู้บริจาค เมื่อพิจารณาว่าการติดเชื้อทางหลอดเลือด โดยปกติแล้วจะมีการนำปรสิตเข้ามาเพียงไม่กี่ตัว (โดยเฉพาะการฉีด) ระยะฟักตัวอาจยาวนานได้ถึง 3 เดือน (ในทางตรงกันข้าม หากติดเชื้อจำนวนมาก ระยะฟักตัวอาจสั้นมากถึงหลายวัน) ซึ่งเป็นสิ่งสำคัญที่ต้องทราบเมื่อวินิจฉัยโรคมาเลเรียในผู้ป่วยที่ได้รับการผ่าตัดและผู้ติดยาเสพติด
สถานการณ์การแพร่ระบาดของมาเลเรีย
เพื่อให้มาเลเรียแพร่กระจายในพื้นที่ใดพื้นที่หนึ่ง (ประเทศ, ดินแดน, พื้นที่) จะต้องมีเงื่อนไขดังต่อไปนี้:
- แหล่งที่มาของการติดเชื้อ (ผู้ป่วยมาเลเรียหรือเป็นพาหะของปรสิต)
- การมีพาหะที่มีประสิทธิภาพ (ยุงสกุล Anopheles) ความอ่อนไหวต่อปรสิตมาลาเรียเป็นคุณสมบัติหลักของยุงสายพันธุ์เฉพาะในสกุล Anopheles จำนวนยุงสกุล Anopheles เมื่อเทียบกับยุงสายพันธุ์อื่นไม่มากเท่ากับยุงที่ไม่ใช่มาลาเรีย และยุงสายพันธุ์นี้ไม่ค่อยสนใจการกัดของยุงมากนัก อย่างไรก็ตาม แม้แต่สายพันธุ์เล็กๆ ในสภาพแวดล้อมที่เอื้ออำนวยอื่นๆ (แหล่งเพาะพันธุ์ยุงใกล้กับที่อยู่อาศัยของมนุษย์) ก็สามารถมีบทบาทสำคัญได้พอสมควร ยุงสกุล Anopheles มากกว่า 70 สายพันธุ์ (จากทั้งหมดมากกว่า 200 สายพันธุ์ที่ทราบ) สามารถเป็นพาหะของมาลาเรียที่มีประสิทธิภาพได้
- สภาพภูมิอากาศที่เอื้ออำนวย: อุณหภูมิอากาศเฉลี่ยรายวันสูงกว่า 16 °C และมีแหล่งเพาะพันธุ์ยุง เช่น แหล่งน้ำ แหล่งน้ำ โครงสร้างชลประทาน เป็นต้น อุณหภูมิอากาศเฉลี่ยรายวันขั้นต่ำที่จำเป็นสำหรับการเจริญเติบโตในร่างกายของยุง Pl. vivax คือ 16 °C สำหรับ Pl. falciparum คือ 18 °C ที่อุณหภูมิต่ำกว่านี้จะไม่เกิดการสืบพันธุ์แบบอาศัยเพศ ระยะเวลาของการสืบพันธุ์แบบอาศัยเพศจะสั้นลง ยิ่งอุณหภูมิสูงขึ้น (ถึงระดับหนึ่ง เนื่องจากอุณหภูมิเฉลี่ยรายวัน 30 °C ขึ้นไปไม่เอื้ออำนวยต่อการสืบพันธุ์แบบอาศัยเพศ) เมื่ออุณหภูมิเฉลี่ยรายวันเหมาะสมที่สุด (25-26 °C) การสืบพันธุ์แบบอาศัยเพศใน Pl. vivax จะใช้เวลา 8-9 วัน สำหรับ Pl. falciparum คือ 10-11 วัน
พื้นที่การกระจายพันธุ์ของมาเลเรียทั้งหมดบนโลก (ระหว่างละติจูด 45° เหนือ และละติจูด 40° ใต้ ถึงละติจูด 64° เหนือ และละติจูด 45° ใต้ ในปีต่างๆ) ถูกครอบครองโดยมาเลเรียชนิดไวแวกซ์ พื้นที่ของมาเลเรียชนิดฟัลซิปารัมและมาเลเรียอี มาลาเรียอี มีขนาดเล็กกว่าเล็กน้อยเนื่องจากต้องใช้อุณหภูมิที่สูงกว่าเพื่อก่อโรคได้ พื้นที่ของมาเลเรียชนิดโอวาเลตั้งอยู่ในสองภูมิภาคที่ไม่มีอาณาเขตเชื่อมต่อกัน: แอฟริกาเขตร้อนและรัฐทางฝั่งตะวันตกของมหาสมุทรแปซิฟิก (อินโดนีเซีย เวียดนาม ฟิลิปปินส์ นิวกินี ฯลฯ) ในประเทศภูเขา จุดกำเนิดของมาเลเรียสามารถก่อตัวได้ที่ระดับความสูงถึง 1,000 เมตรในเขตภูมิอากาศอบอุ่น และสูงถึง 1,500-2,500 เมตรในเขตกึ่งร้อนและเขตร้อน โดยจุดกำเนิดของมาเลเรียชนิดไวแวกซ์เพียงอย่างเดียวจะเกิดขึ้นที่ระดับความสูง (1,000-1,500 เมตรขึ้นไป)
โรคมาลาเรียมีลักษณะเฉพาะคือมีฤดูกาลที่ชัดเจน ในภูมิอากาศแบบอบอุ่นและกึ่งร้อน ฤดูของโรคมาลาเรียจะแบ่งออกเป็นช่วงที่มีการติดเชื้อยุงอย่างได้ผล ช่วงที่เชื้อแพร่กระจาย และช่วงที่โรคแสดงอาการเป็นกลุ่ม ช่วงเริ่มต้นของการติดเชื้อยุงอย่างได้ผล (ในกรณีที่มีแหล่งติดเชื้อ เช่น ผู้ป่วยหรือพาหะของปรสิต) ตรงกับช่วงที่อุณหภูมิเฉลี่ยรายวันเพิ่มขึ้นอย่างสม่ำเสมอถึง 16 องศาเซลเซียส ช่วงเริ่มต้นของช่วงการแพร่กระจายเกี่ยวข้องกับช่วงที่ยุงสร้างสปอร์ในร่างกายเสร็จสิ้น ซึ่งขึ้นอยู่กับอุณหภูมิเฉลี่ยรายวันเฉพาะของปีนั้นๆ ในภูมิภาคมอสโก ช่วงการแพร่กระจายของโรคมาลาเรียชนิดไวแวกซ์อาจยาวนานถึง 1.5-2 เดือนหรือมากกว่านั้น จนกว่าจะถึงช่วงน้ำค้างแข็งครั้งแรกในฤดูใบไม้ร่วง ขอบเขตของช่วงที่โรคแสดงอาการเป็นกลุ่มนั้นไม่ชัดเจนนัก ในจุดที่มีการติดเชื้อมาลาเรียเพียงสามวัน อาจเริ่มมีโรคในกลุ่มได้ก่อนช่วงการแพร่กระจายจะเริ่มขึ้นนาน กรณีที่สังเกตพบคืออาการหลักของมาเลเรียชนิด vivax ที่มีระยะฟักตัวนาน (3-10 เดือน) ซึ่งเกิดจากการติดเชื้อในฤดูกาลก่อนหน้าและยังคงมีฮิปโนโซอิตอยู่ในตับ (โดยไม่มีอาการหลักที่มีระยะฟักตัวสั้น) รวมถึงการกำเริบของโรคนอกเม็ดเลือดแดงในระยะห่างไกล (หลังจากการโจมตีของมาเลเรียหลายครั้งที่มีระยะฟักตัวสั้นในฤดูกาลก่อนหน้าโดยไม่ได้รับการบำบัดป้องกันการกำเริบของโรคที่เหมาะสม)
ความอ่อนไหวต่อมาเลเรียนั้นพบได้ทั่วไป ผลของการติดเชื้อหลังจากที่เชื้อก่อโรคเข้าสู่กระแสเลือดและแนวทางการรักษาทางคลินิกของโรคนั้นกำหนดโดยสถานะภูมิคุ้มกันของแต่ละบุคคล การทำงานของปัจจัยต้านทานโดยกำเนิดที่ไม่จำเพาะ ความเข้มข้นของภูมิคุ้มกันหลังการติดเชื้อ และสำหรับทารกแรกเกิด - ระดับของแอนติบอดีจำเพาะของคลาส G ที่ได้รับจากแม่ ข้อยกเว้นคือชนพื้นเมืองของแอฟริกาตะวันตกและนิวกินี ซึ่งส่วนใหญ่มีภูมิคุ้มกันต่อการติดเชื้อจาก Pl. vivax ซึ่งเกี่ยวข้องกับการไม่มีไอโซแอนติเจนของเม็ดเลือดแดงของกลุ่ม Duffy ที่กำหนดทางพันธุกรรม ซึ่งทำหน้าที่เป็นตัวรับสำหรับเมอโรซอยต์ของ Pl. vivax ดังนั้น ในภูมิภาคนี้ จึงพบกรณีการติดเชื้อมาเลเรียจาก vivax น้อยกว่าในภูมิภาคอื่นๆ ของแอฟริกาเขตร้อนอย่างเห็นได้ชัด
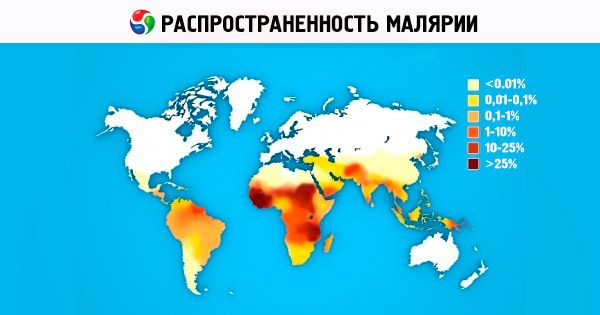
ผู้ที่มีฮีโมโกลบินผิดปกติ (ธาลัสซีเมีย โรคเม็ดเลือดรูปเคียว ฮีโมโกลบินอี ซี ฯลฯ) ที่มีความผิดปกติของโครงสร้างโครงร่างเซลล์เม็ดเลือดแดง (hereditary spherocytosis, southeastern ovalocytosis, hereditary elliptocytosis) หรือผู้ที่มีเอนไซม์กลูโคส-6-ฟอสเฟตดีไฮโดรจีเนสในเม็ดเลือดแดงบกพร่อง จะมีความต้านทานต่อการติดเชื้อพลาสโมเดียทุกประเภทได้ ในกรณีของการติดเชื้อมาลาเรีย พวกเขาจะมีอาการป่วยเล็กน้อย จำนวนปรสิตในเลือดยังคงอยู่ในระดับที่ค่อนข้างต่ำ และแทบจะไม่มีกรณีของการลุกลามของมะเร็ง (มาลาเรียในสมอง - ฟัลซิปารัม) ในทางกลับกัน ผู้ที่มีการขาดกลูโคส-6-ฟอสเฟตดีไฮโดรจีเนสมีความเสี่ยงที่จะเกิดภาวะเม็ดเลือดแดงแตกเฉียบพลันเมื่อใช้ยาต้านมาลาเรียหลายชนิด (ไพรมาควิน ควินิน ฯลฯ) กลไกของการต้านทานตามธรรมชาติต่อมาเลเรียแต่ละชนิดยังคงไม่ชัดเจนนักและยังคงมีการศึกษาวิจัยอยู่ต่อไป
ทารกแรกเกิดยังมีความต้านทานต่อการติดเชื้อมาลาเรียทุกประเภทด้วย เนื่องมาจาก:
- การมีภูมิคุ้มกันแบบพาสซีฟเนื่องจากแอนติบอดีคลาส G ที่ทารกแรกเกิดได้รับจากมารดาที่มีภูมิคุ้มกันสูง (ในพื้นที่ที่มีอุบัติการณ์มาเลเรียสูง)
- รักษาภูมิคุ้มกันจำเพาะหลังคลอดเนื่องจากได้รับแอนติบอดีคลาสเอจากทารกแรกเกิดผ่านทางน้ำนมแม่
- การมีฮีโมโกลบินของทารกในครรภ์ในทารกแรกเกิด ซึ่งไม่มีประโยชน์มากนักในการเลี้ยงปรสิตมาลาเรีย
ภายหลังจากสามถึงหกเดือนแรกของชีวิต ทารกแรกเกิดจะมีความเสี่ยงเพิ่มขึ้นอย่างมีนัยสำคัญในการเป็นโรคมาเลเรียฟัลซิปารัมชนิดรุนแรงและเป็นมะเร็ง (การเปลี่ยนแปลงของเม็ดเลือดแดงที่มีฮีโมโกลบินของทารกในครรภ์ไปเป็นเม็ดเลือดแดงที่มีฮีโมโกลบินปกติ การเปลี่ยนผ่านไปเป็นการให้อาหารผสม - การบริโภคกรดพารา-อะมิโนเบนโซอิก ซึ่งจำเป็นต่อการพัฒนาของปรสิต ซึ่งไม่มีอยู่ในน้ำนมแม่)
 [ 10 ], [ 11 ], [ 12 ], [ 13 ]
[ 10 ], [ 11 ], [ 12 ], [ 13 ]
ภูมิคุ้มกันในโรคมาลาเรีย
ภูมิคุ้มกันต่อมาเลเรียเป็นภูมิคุ้มกันที่ไม่เป็นหมัน จำเพาะต่อชนิดและสายพันธุ์ ไม่เสถียร และอยู่ได้ไม่นาน เพื่อรักษาระดับการป้องกันของแอนติบอดี จำเป็นต้องกระตุ้นแอนติเจนอย่างต่อเนื่องในรูปแบบของการติดเชื้อมาเลเรียซ้ำๆ ภูมิคุ้มกันต่อ Pl. malariae และ Pl. vivax เกิดขึ้นเร็วกว่าและคงอยู่ได้นานกว่า Pl. falciparum ภูมิคุ้มกันต่อมาเลเรียรวมถึงการตอบสนองของเซลล์และของเหลว กระบวนการภูมิคุ้มกันที่กระตุ้นการสังเคราะห์แอนติบอดีเริ่มต้นด้วยการที่แมคโครฟาจจับกินปรสิตมาเลเรีย ซึ่งแสดงออกมาโดยการเพิ่มจำนวนของระบบฮิสติโอฟาโกไซต์ของม้าม ตับ และไขกระดูก
การระบาดของโรคมาเลเรีย
จากเชื้อก่อโรคมาลาเรียในมนุษย์ทั้ง 4 ชนิด P. vivax เป็นเชื้อที่พบมากที่สุดในโลก ในเขตกึ่งร้อนและเขตร้อน สปอโรซอยต์เป็นสปอร์ของยีนในประชากร P. vivax มากที่สุด โดยทำให้เกิดโรคได้หลังจากฟักตัวเป็นเวลาสั้นๆ (10-21 วัน) ในทวีปแอฟริกา พบ P. vivax อยู่บ่อยครั้งในประเทศทางแอฟริกาตะวันออกในหมู่ชาวอาหรับ อินเดีย เอธิโอเปีย และยุโรป ในประเทศทางแอฟริกาตะวันตก ซึ่งมีประชากรส่วนใหญ่เป็นชาวผิวสี ไม่พบ P. vivax ซึ่งอธิบายได้จากภูมิคุ้มกันโดยกำเนิดที่กำหนดทางพันธุกรรมของคนผิวสีในแอฟริกาต่อ P. vivax [เม็ดเลือดแดงไม่มีตัวรับเมโรซอยต์ของ P. vivax - ไอโซแอนติเจนดัฟฟี่ (Fy dหรือ Fy b )] P. ovale มีจำนวนน้อยและประกอบด้วยสองส่วน พื้นที่หลักของแอฟริกาครอบคลุมถึงแอฟริกาเขตร้อนตั้งแต่แกมเบียทางตอนเหนือไปจนถึงคองโกทางตอนใต้ของทวีป ส่วนพื้นที่ที่สองของพื้นที่คือประเทศในมหาสมุทรแปซิฟิกตะวันตกและเอเชียตะวันออกเฉียงใต้ พื้นที่ทางภูมิศาสตร์ของมาเลเรียเขตร้อนครอบคลุมละติจูด 40 องศาเหนือและละติจูด 20 องศาใต้ P. falciparum ก่อให้เกิดโรคมาเลเรียสูงถึง 50% ของผู้ป่วยทั้งหมดทั่วโลก ปัจจุบันพบมาเลเรียชนิดโฟร์เดย์ในแอฟริกา บางพื้นที่ในอเมริกากลางและอเมริกาใต้ และแคริบเบียน เอเชียตะวันออกเฉียงใต้
คนส่วนใหญ่มักจะติดเชื้อมาเลเรียได้ง่าย ยกเว้นประชากรพื้นเมืองของแอฟริกาตะวันตก พื้นที่ที่มีการระบาดของเชื้อ P. falciparum มากเกินไปในแอฟริกาเขตร้อนนั้นมีลักษณะเด่นคือโครงสร้างภูมิคุ้มกันที่ค่อนข้างเสถียรของประชากรพื้นเมือง:
- เด็กอายุน้อยกว่า 6 เดือนไม่ป่วยเนื่องจากภูมิคุ้มกันแบบพาสซีฟที่ได้รับจากแม่:
- เด็กอายุ 6-24 เดือนส่วนใหญ่ได้รับเชื้อ P. falciparum ภูมิคุ้มกันแบบพาสซีฟได้ลดลง ในขณะที่ภูมิคุ้มกันแบบแอคทีฟยังไม่พัฒนาขึ้น กลุ่มนี้มีอัตราการเสียชีวิตจากมาลาเรียสูงที่สุด:
- ในเด็กอายุมากกว่า 2 ปี เชื้อ P. falciparum จะตรวจพบได้น้อยลง การดำเนินของโรคมาเลเรียจะบรรเทาลงอันเป็นผลจากภูมิคุ้มกันที่ได้รับ และความรุนแรงของการติดเชื้อปรสิตในเลือดจะลดลงตามอายุ:
- ในผู้ใหญ่ P. falciparum ตรวจพบได้น้อยเนื่องจากภูมิคุ้มกันมีระดับสูง เมื่อติดเชื้อจะไม่มีอาการทางคลินิกเกิดขึ้น
โรคมาลาเรียเขตร้อนยังสามารถทนต่อผู้ที่มีฮีโมโกลบิน S ที่ผิดปกติ (โรคเม็ดเลือดรูปเคียว) และผู้ที่มีความผิดปกติทางพันธุกรรมอื่นๆ ของฮีโมโกลบินและเอนไซม์เม็ดเลือดแดง (ภาวะขาด G-6-PDH) ได้อย่างง่ายดาย
ประวัติการวิจัยมาเลเรีย
การศึกษาเกี่ยวกับมาเลเรีย (โรคของมนุษย์ที่เก่าแก่ที่สุดโรคหนึ่ง) มีความเกี่ยวพันอย่างแยกไม่ออกกับประวัติศาสตร์อารยธรรมของมนุษย์ สันนิษฐานว่ามาเลเรียเริ่มแพร่กระจายบนโลก (จากภูมิภาคเมดิเตอร์เรเนียนของแอฟริกา) เมื่อประมาณ 10,000 ปีก่อนเนื่องมาจากการพัฒนาอย่างเข้มข้นของการเกษตร การค้า และการสำรวจดินแดนใหม่ ในกระดาษปาปิรัสอียิปต์โบราณ วรรณกรรมจีนโบราณ และหลักเกณฑ์การแพทย์คลาสสิกของอินเดียโบราณ (อายุรเวช) คำอธิบายเกี่ยวกับภาพทางคลินิกและการระบาดของมาเลเรียยังคงมีอยู่จนถึงทุกวันนี้ แม้กระทั่งในสมัยนั้น ก็ยังมีการตั้งสมมติฐานเกี่ยวกับความเชื่อมโยงที่เป็นไปได้ระหว่างการพัฒนาของโรคและการถูกยุงกัด ต่อมา (ศตวรรษที่ 5-6 ก่อนคริสตกาล) แพทย์ชาวกรีกโบราณ เช่น ฮิปโปเครตีส เฮราโดตัส และเอมเพโดคลีส ได้บรรยายภาพทางคลินิกของมาเลเรียอย่างละเอียด ฮิปโปเครตีสได้รับการยกย่องว่าเป็นผู้แยกมาลาเรียออกจากกลุ่มโรคไข้ โดยเขาเสนอให้แยกโรคออกเป็น 3 รูปแบบ คือ “ประจำวัน” (อาการกำเริบทุกวัน) “เทอร์เชียน” (อาการกำเริบทุก ๆ วันเว้นวัน) และ “ควาร์แทน” (อาการกำเริบทุก ๆ 2 วัน)
ยุคแห่งการค้นพบทางวิทยาศาสตร์เกี่ยวกับมาเลเรียเริ่มต้นขึ้นในปี ค.ศ. 1640 เมื่อแพทย์ชาวสเปนและนักล่าอาณานิคมชื่อ Juan del Vego ได้ใช้เปลือกซิงโคนาเป็นยารักษาผู้ป่วยมาเลเรียเป็นครั้งแรก ซึ่งก่อนหน้านี้ชาวอินเดียในเปรูและเอกวาดอร์ใช้เป็นยาลดไข้ การให้เครดิตสำหรับการตั้งชื่อโรคนี้ว่า "มาเลเรีย" (ภาษาอิตาลี: "mal aria" - อากาศเสีย) ตกเป็นของ Lancisi ชาวอิตาลี (ค.ศ. 1717) ซึ่งเชื่อมโยงการติดเชื้อมาเลเรียในคนกับไอระเหย "พิษ" จากหนองบึง ในปี ค.ศ. 1880 แพทย์ชาวฝรั่งเศส A. Laveran ซึ่งทำงานในแอลจีเรีย ได้อธิบายอย่างละเอียดเกี่ยวกับสัณฐานวิทยาของเชื้อก่อโรคมาเลเรีย ในปี ค.ศ. 1897 แพทย์ทหารชาวอังกฤษ Ronald Ross ในอินเดียได้กำหนดกลไกการแพร่กระจายของมาเลเรีย
ปัจจุบันมาเลเรียเป็นปัญหาสุขภาพที่ร้ายแรงที่สุดอย่างหนึ่งสำหรับประเทศต่างๆ มากกว่า 100 ประเทศในแอฟริกา เอเชีย และอเมริกาใต้ ประชากรโลกประมาณครึ่งหนึ่งมีความเสี่ยงที่จะติดเชื้อมาเลเรีย ประเทศต่างๆ เกือบทั้งหมดในยุโรปและอเมริกาเหนือพบผู้ป่วยมาเลเรียที่เดินทางมาจากภูมิภาคที่มีการระบาดของโรคนี้เป็นจำนวนมากทุกปี จำนวนผู้ป่วยมาเลเรียที่เดินทางมาจากสนามบินก็เพิ่มขึ้นเรื่อยๆ ตามข้อมูลขององค์การอนามัยโลก ประชากรโลก 200-250 ล้านคนป่วยด้วยมาเลเรียทุกปี โดยอย่างน้อย 80% ของผู้ป่วยมาเลเรียทั้งหมดอยู่ในประเทศในแอฟริกาที่ตั้งอยู่ทางใต้ของทะเลทรายซาฮารา ทุกปีมีผู้เสียชีวิตจากมาเลเรีย 1-2 ล้านคน โดยส่วนใหญ่เป็นเด็กอายุต่ำกว่า 5 ปี การสูญเสียทางสังคมและเศรษฐกิจในแอฟริกาเพียงอย่างเดียวมีมูลค่าประมาณ 2 พันล้านดอลลาร์สหรัฐต่อปี ตั้งแต่ปี 1998 เป็นต้นมา ภายใต้การอุปถัมภ์ขององค์การอนามัยโลก ธนาคารโลก และองค์การยูนิเซฟ ได้มีการนำโปรแกรมทางวิทยาศาสตร์และปฏิบัติ (Roll Back Malaria Initiative) เพื่อควบคุมมาเลเรีย (โดยเฉพาะในประเทศกำลังพัฒนา) มาใช้ โครงการดังกล่าวมีกำหนดดำเนินการจนถึงปี 2010-2015 การพัฒนาวัคซีนป้องกันมาเลเรียที่มีประสิทธิภาพกำลังดำเนินการอยู่ แต่จะต้องใช้เวลาอีกอย่างน้อย 10-15 ปี การค้นหา พัฒนา และปรับปรุงยารักษาโรคมาเลเรียเป็นหนึ่งในโครงการสำคัญของ WHO บริษัทเภสัชกรรมต่างๆ และสถาบันวิจัยทั่วโลก ในช่วงไม่กี่ปีที่ผ่านมา รัสเซียพบว่ามีผู้ป่วยโรคมาเลเรียที่นำเข้าจากต่างประเทศเพิ่มมากขึ้น เนื่องมาจากการอพยพระหว่างประเทศที่เพิ่มขึ้นและการพัฒนาการท่องเที่ยวระหว่างประเทศอย่างเข้มข้น
สาเหตุ มาลาเรีย
ชื่อของโรค "มาเลเรีย" จริงๆ แล้วครอบคลุมถึงโรคโปรโตซัว 4 ชนิดที่แยกจากกัน เกิดจากเชื้อก่อโรค 4 ชนิดตามลำดับ
มาเลเรียเกิดจากปรสิตที่อยู่ในกลุ่ม Protozoa class, Sporozoa, family Plasmodiidae, genus Plasmodium เชื้อก่อโรค 4 ชนิดอาศัยอยู่ในมนุษย์ ได้แก่ P. vivax ทำให้เกิดมาเลเรีย 3 วัน, P. malariae ทำให้เกิดมาเลเรีย 4 วัน, P. falciparum ทำให้เกิดมาเลเรียเขตร้อน และ P. ovale ทำให้เกิดมาเลเรีย 3 วัน ovale
เชื้อก่อโรคมาลาเรีย
การกระตุ้น |
รูปแบบของโรคมาเลเรีย (ตาม ICD-10) |
พลาสโมเดียม (Laverania) ฟัลซิพารัม |
มาลาเรียเกิดจากพลาสโมเดียมฟัลซิพารัม (ฟัลซิพารัมมาลาเรีย) |
พลาสโมเดียม (Plasmodium) ไวแวกซ์ |
โรคมาลาเรียที่เกิดจากเชื้อพลาสโมเดียมวิแวกซ์ (มาลาเรีย-วิแวกซ์) |
พลาสโมเดียม (Plasmodium) โอวาเล่ |
โรคมาลาเรียที่เกิดจากเชื้อ Plasmodium ovale (มาลาเรีย-โอวาเล) |
พลาสโมเดียม (Plasmodium) มาลาเรีย |
มาลาเรียเกิดจากพลาสโมเดียมมาลาเรีย (มาลาเรีย-มาลาเรีย) |
ในสิ่งพิมพ์ภายในประเทศส่วนใหญ่ (ตำราเรียน คู่มือ หนังสืออ้างอิง) จะยังคงใช้ชื่อสกุลเดิมของมาเลเรียไว้ ได้แก่ มาเลเรียเขตร้อน (มาเลเรีย-ฟัลซิปารัม) มาเลเรียสามวัน (มาเลเรีย-วิแวกซ์) มาเลเรียรูปวงรี (มาเลเรีย-โอวาเล) และมาเลเรียสี่วัน (มาเลเรีย-มาเลเรียอี)
มาลาเรียทั้ง 4 ชนิดมีลักษณะทางคลินิก พยาธิวิทยา และระบาดวิทยาเฉพาะตัว โดยมาลาเรียชนิดฟัลซิปารัมถือเป็นชนิดที่สำคัญที่สุด โดยคิดเป็นร้อยละ 80-90 ของผู้ป่วยมาลาเรียทั้งหมดทั่วโลก โดยเชื้อที่ทำให้เกิดโรคอยู่ในสกุลย่อยพิเศษ (Laverania) มาลาเรียชนิดฟัลซิปารัมเท่านั้นที่สามารถลุกลามเป็นมะเร็งและเสียชีวิตได้
ในช่วงวงจรชีวิต เชื้อก่อโรคมาลาเรียจะผ่านวงจรการพัฒนาต่อไปนี้ โดยมีการเปลี่ยนโฮสต์:
- การพัฒนาแบบไม่อาศัยเพศ (schizogony) เกิดขึ้นในร่างกายของโฮสต์ตัวกลาง - มนุษย์
- การพัฒนาทางเพศ (sporogony) เกิดขึ้นในร่างกายของโฮสต์ตัวสุดท้าย ซึ่งก็คือยุงตัวเมียของสกุล Anopheles
สปอโรซอยต์เข้าสู่ร่างกายมนุษย์ผ่านการกัดของยุงที่ติดเชื้อมาลาเรีย หลังจากเข้าสู่กระแสเลือดแล้ว สปอโรซอยต์จะแทรกซึมเข้าไปในเซลล์ตับจากหลอดเลือดไซนัสของตับภายใน 15-45 นาที และเริ่มวงจรการสร้างเม็ดเลือดแดงแบบนอกเซลล์ (tissue schizogony cycle) การเลือกและความเร็วในการบุกรุกเกิดจากการมีตัวรับเฉพาะบนเยื่อหุ้มเซลล์ตับ ปรสิตจะเพิ่มขนาด แบ่งตัวซ้ำแล้วซ้ำเล่า และก่อตัวเป็นกลุ่มโมโนนิวเคลียร์ขนาดเล็กจำนวนมาก ซึ่งก็คือเมอโรซอยต์ วงจรการสร้างเม็ดเลือดแดงแบบนอกเซลล์มีระยะเวลาขั้นต่ำ 5-7 วันสำหรับ P. falciparum, 6-8 วันสำหรับ P. vivax, 9 วันสำหรับ P. ovale และ 14-16 วันสำหรับ P. malariae จากนั้นเมอโรซอยต์จะออกจากเซลล์ตับเข้าสู่กระแสเลือดและแทรกซึมเข้าไปในเซลล์เม็ดเลือดแดง ซึ่งจะมีการสร้างเม็ดเลือดแดงแบบนอกเซลล์ มาลาเรียชนิด 3 วันและชนิด Ovale มีลักษณะเฉพาะคือมีการพัฒนาแบบ exoerythrocytic ในลักษณะพิเศษ คือ ปรสิตทั้งหมดหรือบางส่วนสามารถอยู่ในเซลล์ตับได้เป็นเวลานาน (7-14 เดือนขึ้นไป) ในสถานะ "หลับใหล" (hypnozoite) และหลังจากช่วงเวลานี้เท่านั้นที่ปรสิตจึงจะเริ่มเปลี่ยนเป็น merozoite ที่สามารถติดเชื้อในเม็ดเลือดแดงได้ ดังนั้น จึงกำหนดความเป็นไปได้ของการฟักตัวในระยะยาวและการเกิดอาการกำเริบซ้ำในระยะไกลได้นานถึง 3 ปี
การแบ่งตัวของเม็ดเลือดแดงแบบแยกตัวจะมาพร้อมกับการพัฒนาเป็นวงจรและการแบ่งตัวของปรสิตหลายตัว โดยพลาสโมเดียของมาเลเรียจะผ่านระยะต่อไปนี้: โทรโฟโซอิตอายุน้อย (มีรูปร่างเป็นวงแหวน); โทรโฟโซอิตที่กำลังพัฒนา; โทรโฟโซอิตที่โตเต็มที่ (มีนิวเคลียสขนาดใหญ่): ชิซอนต์ที่กำลังพัฒนา; ชิซอนต์ที่โตเต็มที่ หลังจากกระบวนการแบ่งตัวของเม็ดเลือดแดงเสร็จสิ้น เมอโรโซอิตอิสระจะแทรกซึมเข้าไปในเม็ดเลือดแดงใหม่ได้อย่างแข็งขัน แต่ส่วนใหญ่จะตายจากผลของกลไกภูมิคุ้มกันป้องกันของโฮสต์ ระยะเวลาของการแบ่งตัวของเม็ดเลือดแดงแบบแยกตัวคือ 48 ชั่วโมงใน P. vivax, P. ovale, P. falciparum และ 72 ชั่วโมงใน P. malariae ในระหว่างวงจรของเม็ดเลือดแดง เมอโรโซอิตบางส่วนจะเปลี่ยนเป็นรูปแบบทางเพศ ได้แก่ ตัวเมีย (แมโครกาเมโตไซต์) หรือตัวผู้ (ไมโครกาเมโตไซต์)
เซลล์สืบพันธุ์เพศผู้จะเข้าสู่ร่างกายของยุงที่แพร่เชื้อเมื่อยุงดูดเลือดของผู้ป่วยมาลาเรียหรือพาหะปรสิต เซลล์สืบพันธุ์เพศผู้จะเจริญเต็มที่ เมื่ออยู่ในกระเพาะของยุง หลังจากผ่านไป 9-12 นาที เซลล์สืบพันธุ์เพศผู้จะขับแฟลกเจลลาที่เคลื่อนที่ได้บาง ๆ จำนวน 8 ชิ้น แฟลกเจลลาอิสระ (ไมโครกาเมต) จะแทรกซึมเข้าไปในเซลล์เพศเมีย (แมโครกาเมต) หลังจากนิวเคลียสหลอมรวมกันแล้ว ไซโกตจะก่อตัวขึ้น ซึ่งเป็นเซลล์กลมที่ได้รับการผสมพันธุ์ จากนั้น โอคิเนต ซึ่งเป็นโอโอซีสต์ที่มีสปอโรซอยต์จะพัฒนาตามลำดับ โดยจะเจริญเติบโตเต็มที่ในต่อมน้ำลายของยุง ที่อุณหภูมิอากาศแวดล้อมที่เหมาะสม (25 °C) สปอโรโกนีจะคงอยู่ได้ 10 วันใน P. vivax 12 วันใน P. falciparum 16 วันใน P. malariae และ P. ovale ที่อุณหภูมิอากาศต่ำกว่า 15 °C สปอโรซอยต์จะไม่เติบโต
จุลชีพก่อโรค
กลไกการเกิดโรค
อาการทั้งหมดของมาเลเรียเกิดจาก erythrocytic schizogony ซึ่งเป็นการเจริญเติบโตและการสืบพันธุ์ของปรสิตในรูปแบบเม็ดเลือดแดงแบบไม่อาศัยเพศในเลือด การแยกตัวของเนื้อเยื่อไม่แสดงอาการทางคลินิก
การโจมตีของมาเลเรียสัมพันธ์กับการเกิด erythrocytic schizogony ที่สมบูรณ์ การสลายตัวของเม็ดเลือดแดงจำนวนมาก และการเข้าสู่กระแสเลือดของเมอโรโซไอต์จำนวนมาก ซึ่งเป็นผลิตภัณฑ์จากการเผาผลาญของปรสิตที่มีคุณสมบัติเป็นไข้และเป็นพิษที่กระตุ้นให้เกิดปฏิกิริยาไข้ เนื่องจากลักษณะวงจรของ erythrocytic schizogony การโจมตีด้วยไข้จะเกิดขึ้นซ้ำทุก ๆ 48 ชั่วโมงในมาลาเรีย 3 วัน มาลาเรียรูปไข่และมาลาเรียเขตร้อน และทุก ๆ 72 ชั่วโมงในมาลาเรีย 4 วัน เมื่อบุคคลได้รับเชื้อ ประชากรของปรสิตมาลาเรียที่หลากหลายจะเข้าสู่ร่างกาย และ schizogony ในระยะเริ่มต้นจะเกิดขึ้นแบบไม่พร้อมกัน ซึ่งทำให้ประเภทของไข้ไม่สม่ำเสมอ เมื่อปฏิกิริยาภูมิคุ้มกันพัฒนาขึ้น ความสามารถในการเป็นปรสิตในเม็ดเลือดแดงจะถูกเก็บรักษาไว้ในพลาสโมเดียรุ่นหลักหนึ่งรุ่น ซึ่งจะกำหนดจังหวะของไข้ซึ่งเป็นลักษณะเฉพาะของสปีชีส์นี้ เฉพาะในมาเลเรียเขตร้อนเท่านั้นที่อาจมีพลาสโมเดียหลายรุ่น (2-3) รุ่นหลัก ดังนั้นไข้จึงมักจะไม่สม่ำเสมอ
โรคโลหิตจางซึ่งเป็นลักษณะเฉพาะของโรคมาเลเรียเป็นผลมาจากการทำลายเม็ดเลือดแดงโดยปรสิตที่อยู่ในเม็ดเลือดแดง เป็นที่ทราบกันดีว่า P. vivax และ P. ovale แทรกซึมเข้าไปในเม็ดเลือดแดงอายุน้อยเป็นหลัก P. malariae เข้าสู่เม็ดเลือดแดงที่โตเต็มที่ P. falciparum ติดเชื้อเม็ดเลือดแดงที่โตเต็มที่ในระดับต่างๆ ซึ่งทำให้เม็ดเลือดแดงเสียหายและแตกสลายได้ ดังนั้นในโรคมาเลเรียเขตร้อน การแตกสลายของเม็ดเลือดแดงจึงมีบทบาทสำคัญในการก่อให้เกิดโรคโลหิตจาง ปัจจัยเพิ่มเติมที่ทำให้เม็ดเลือดแดงแตกยังเป็นกลไกภูมิคุ้มกันทำลายเม็ดเลือดแดงที่ไม่ติดเชื้อ การเพิ่มจำนวนเซลล์เม็ดเลือดแดงของม้ามซึ่งเกิดขึ้นในโรคมาเลเรียจะไปยับยั้งการสร้างเม็ดเลือด ทำให้เกิดโรคโลหิตจางและเกล็ดเลือดต่ำ
ตับและม้ามโตนั้นเกิดจากการคั่งของเลือดในอวัยวะต่างๆ ในระยะแรก แต่ไม่นานก็เกิดภาวะลิมฟอยด์และเรติคูโลเอนโดทีเลียมไฮเปอร์พลาเซียขึ้นในอวัยวะเหล่านั้น เป็นผลจากการแตกของเม็ดเลือดแดงและความเสียหายต่อเซลล์ตับ ทำให้เกิดอาการตัวเหลือง การดูดซึมคาร์โบไฮเดรตที่ลดลงและการยับยั้งการสร้างกลูโคสใหม่ในตับทำให้เกิดภาวะน้ำตาลในเลือดต่ำ การกระตุ้นไกลโคไลซิสแบบไม่ใช้ออกซิเจนนำไปสู่การสะสมของแลคเตตในเลือด น้ำไขสันหลัง และการเกิดกรดแลกติก ซึ่งเป็นหนึ่งในสาเหตุของมาเลเรียเขตร้อนที่รุนแรง
ในมาลาเรียเขตร้อน คุณสมบัติของเม็ดเลือดแดงจะเปลี่ยนไป ส่งผลให้การไหลเวียนโลหิตในระดับจุลภาคถูกขัดขวาง (การเกาะติดของเซลล์ การกักเก็บเซลล์ การเรียงตัวของเซลล์) การเกาะติดของเซลล์เม็ดเลือดแดงที่ติดเชื้อจะเกาะติดกับเซลล์เยื่อบุผนังหลอดเลือด ซึ่งเป็นสาเหตุของการกักเก็บเซลล์ในเส้นเลือดฝอยและหลอดเลือดดำหลังเส้นเลือดฝอย บทบาทหลักในการเกาะติดของเซลล์เม็ดเลือดแดงคือโปรตีนลิแกนด์เฉพาะ (การแสดงออกของโปรตีนบนพื้นผิวของเม็ดเลือดแดงเกิดจากปรสิต) และตัวรับที่อยู่บนพื้นผิวภายนอกของเซลล์เยื่อบุผนังหลอดเลือด การอุดตันของหลอดเลือดทำให้เนื้อเยื่อที่ได้รับผลกระทบขาดเลือด เซลล์ที่ยื่นออกมา (ปุ่ม) จะปรากฏขึ้นบนเยื่อหุ้มเซลล์เม็ดเลือดแดง ซึ่งจะสัมผัสกับเซลล์เยื่อบุผนังหลอดเลือดที่มีรูปร่างคล้ายขาเทียม แบคทีเรีย P. falciparum บางสายพันธุ์ทำให้เม็ดเลือดแดงที่แข็งแรงเกาะติดกับเซลล์ที่ติดเชื้อ ส่งผลให้เกิดการสร้าง "โรเซตต์" เซลล์เม็ดเลือดแดงแข็งตัว ซึ่งทำให้คุณสมบัติการไหลของเลือดแย่ลงและทำให้ความผิดปกติของระบบไหลเวียนโลหิตแย่ลง ปัจจัยทำลายล้างที่สำคัญคือภาวะขาดออกซิเจนซึ่งเกิดจากการที่เม็ดเลือดแดงที่ติดเชื้อทำหน้าที่ลำเลียงออกซิเจนได้ไม่เพียงพอ เนื้อเยื่อสมองมีความต้านทานต่อภาวะขาดออกซิเจนน้อยที่สุด ซึ่งส่งผลให้เกิดมาลาเรียในสมอง ความผิดปกติของระบบการแข็งตัวของเลือดอาจเกิดขึ้นได้ ในมาลาเรียเขตร้อนที่รุนแรง อาจพบสัญญาณของกลุ่มอาการ DIC เกล็ดเลือดต่ำ และไฟบรินในเลือดต่ำ ปฏิกิริยาอักเสบที่ไม่จำเพาะโดยทั่วไปมีบทบาทบางอย่างในการก่อโรคมาลาเรียเขตร้อน ความเสียหายของหลอดเลือดเกิดจากการกระทำของตัวกลางการอักเสบเป็นหลัก ผลิตภัณฑ์ที่เกิดปฏิกิริยามากที่สุดคือผลิตภัณฑ์ของลิพิดเปอร์ออกซิเดชันและโปรตีเอสที่หลั่งออกมาจากเม็ดเลือดขาว ในการเกิดโรคมาลาเรียที่รุนแรง ไซโตไคน์โดยเฉพาะ TNF และ IL (IL-2 และ IL-6) จะถูกให้ความสำคัญอย่างมาก การเปลี่ยนแปลงที่มีลักษณะเฉพาะมากที่สุดในโรคมาลาเรียเขตร้อนรุนแรงเกิดขึ้นที่สมอง โดยจะพบอาการบวมน้ำ เนื้อสมองบวม มีเนื้องอกของเซลล์ประสาทรอบหลอดเลือดและรอบแกงเกลีย (เนื้อเยื่อของเดิร์ก) หลอดเลือดฝอยถูกปิดกั้นโดยเม็ดเลือดแดงและปรสิตที่บุกรุก ทำให้เกิดการหยุดเลือดอย่างกว้างขวาง อาการบวมน้ำรอบหลอดเลือดพร้อมเลือดออกและเนื้อตายเฉพาะจุดจะเกิดขึ้น จากภาพทางพยาธิวิทยา สามารถสรุปได้ว่าในกรณีของอาการโคม่าจากมาลาเรีย จะเกิดเยื่อหุ้มสมองอักเสบเฉพาะส่วน
การติดเชื้อมาลาเรียสามารถขัดขวางการตอบสนองทางภูมิคุ้มกันของร่างกาย ซึ่งกระตุ้นให้เกิดปฏิกิริยาทางภูมิคุ้มกันแบบลูกโซ่ การตรึงอิมมูโนโกลบูลินและส่วนประกอบบนเยื่อฐานของไตทำให้เกิดโรคไตอักเสบเฉียบพลัน กลุ่มอาการไตอักเสบซึ่งเกิดขึ้นในผู้ป่วยมาลาเรียที่ติดเชื้อ 4 วัน จัดอยู่ในกลุ่มโรคไตอักเสบจากภูมิคุ้มกันที่ซับซ้อน
วงจรชีวิตของเชื้อก่อโรคมาลาเรียทั้งหมด
วงจรชีวิตของเชื้อก่อโรคมาลาเรียทั้งหมดประกอบไปด้วยสิ่งมีชีวิตสองชนิด คือ มนุษย์ (schizogony - วงจรการพัฒนาแบบไม่อาศัยเพศ) และยุงในสกุล Anopheles (sporogony - วงจรการพัฒนาแบบอาศัยเพศ)
โดยทั่วไป วงจรการแบ่งเซลล์แบบแยกตัว (schizogony cycle) ของปรสิตมาลาเรียทุกสายพันธุ์จะแบ่งออกเป็น 3 ระยะ ได้แก่ การแบ่งเซลล์แบบแยกตัวที่เซลล์เม็ดเลือดแดง (exoerythrocytic schizogony: EESh), การแบ่งเซลล์แบบแยกตัวที่เซลล์เม็ดเลือดแดง (erythrocytic schizogony: ESH) และการแบ่งเซลล์แบบแยกตัวที่เซลล์เม็ดเลือดแดง (gametocytogony) นอกจากนี้ วงจรชีวิตของ Pl. vivax และ Pl. ovale ซึ่งก็คือการจำศีลนั้น เกิดจากการที่สปอโรซอยต์ (tachysporozoites) ซึ่งมีลักษณะทางสัณฐานวิทยาที่แตกต่างกัน (bradysporozoites และ bradysporozoites หรือ bradysporozoites เท่านั้น) ถูกนำเข้าสู่ร่างกายมนุษย์ในระหว่างที่ยุงกัด ในกรณีเหล่านี้ bradysporozoites (hypnozoites) จะถูกเก็บรักษาไว้ในเซลล์ตับเป็นเวลานานในสถานะที่ไม่ทำงานจนกว่าจะเริ่มเกิด EES
 [ 19 ], [ 20 ], [ 21 ], [ 22 ]
[ 19 ], [ 20 ], [ 21 ], [ 22 ]
การแยกตัวของเซลล์เม็ดเลือดแดงแบบนอกเซลล์
สปอโรซอยต์ที่เข้าสู่ร่างกายมนุษย์พร้อมกับน้ำลายยุงจะเข้าสู่ตับพร้อมกับกระแสเลือดอย่างรวดเร็ว (ภายใน 15-30 นาที) ซึ่งพวกมันจะเจาะเข้าไปในเซลล์ตับอย่างแข็งขันโดยไม่ทำลายเซลล์ สปอโรซอยต์ของ Pl. falciparum, Pl. malariae และ tachysporozoites ของ Pl. vivax และ Pl. ovale จะเริ่ม EES ทันทีด้วยการสร้างเมอโรซอยต์นอกเม็ดเลือดแดงจำนวนมาก (มากถึง 40,000 จากสปอโรซอยต์หนึ่งในมาลาเรียฟัลซิปารัม) เซลล์ตับจะถูกทำลาย และเมอโรซอยต์จะเข้าสู่กระแสเลือดอีกครั้งโดยแทรกซึมเข้าไปในเม็ดเลือดแดงอย่างรวดเร็ว (ภายใน 15-30 นาที) ระยะเวลาของ EES สำหรับมาลาเรียฟัลซิปารัมคือ 6 วัน สำหรับมาลาเรียฟัลซิปารัมคือ 8 วัน สำหรับมาลาเรียโอวาเฟคือ 9 วัน สำหรับมาลาเรียมาเลเรียมาเลเรียคือ 15 วัน
 [ 23 ], [ 24 ], [ 25 ], [ 26 ], [ 27 ], [ 28 ], [ 29 ]
[ 23 ], [ 24 ], [ 25 ], [ 26 ], [ 27 ], [ 28 ], [ 29 ]
ระยะพักตัว
ในมาลาเรียชนิด vivax และมาลาเรียชนิด ovale แบรดีสปอโรซอยต์ที่แทรกซึมเข้าไปในเซลล์ตับจะเปลี่ยนเป็นรูปแบบที่ไม่ทำงาน - ฮิปโนซอยต์ ซึ่งสามารถคงอยู่ได้โดยไม่แบ่งตัวเป็นเวลาหลายเดือนหรือหลายปีจนกว่าจะมีการทำงานอีกครั้งในภายหลัง (การแบ่งตัวและการก่อตัวของเมอโรซอยต์) ดังนั้น ฮิปโนซอยต์จึงเกี่ยวข้องกับการฟักตัวเป็นเวลานาน (นานถึง 3-10 เดือนหรือมากกว่านั้น) และการพัฒนาของการกำเริบของโรคเอคโซเอริโทรไซต์ระยะไกล ซึ่งเป็นลักษณะเฉพาะของมาลาเรียรูปแบบเหล่านี้เท่านั้น
ภาวะเม็ดเลือดแดงแตกแบบแยกตัว
หลังจากนำเมอโรโซอิตเข้าสู่เม็ดเลือดแดง ปรสิตมาลาเรียจะผ่านขั้นตอนต่างๆ ซ้ำแล้วซ้ำเล่า (เป็นวัฏจักร) ตามลำดับ ได้แก่ ระยะโทรโฟโซอิต (เซลล์โมโนนิวเคลียร์ที่กินอาหาร) ระยะชิซอนต์ (เซลล์หลายนิวเคลียร์ที่แบ่งตัว) และระยะมอรูลา (ปรสิตที่ก่อตัวอยู่ภายในเม็ดเลือดแดง) ต่อจากนั้น หลังจากเม็ดเลือดแดงถูกทำลาย เมอโรโซอิตจะเข้าสู่พลาสมาของเลือด เมอโรโซอิตลูกจำนวนมากที่สุดเกิดขึ้นในมาลาเรียเขตร้อน โดยมีมากถึง 40 ตัวในเม็ดเลือดแดง 1 เซลล์ ระยะ ES มีระยะเวลาที่กำหนดอย่างเคร่งครัด คือ 48 ชั่วโมงสำหรับมาลาเรียฟัลซิปารัม มาลาเรียไวแวกซ์ มาลาเรียโอวาเล และ 72 ชั่วโมงสำหรับมาลาเรีย

ลักษณะเฉพาะของวงจร schizogony ของเม็ดเลือดแดงและกลไกการก่อโรคหลักในการพัฒนาของมาเลเรียฟัลซิปารัมในรูปแบบที่รุนแรงและซับซ้อน:
- การสะสม (การกักเก็บ) ของเซลล์เม็ดเลือดแดงที่บุกรุกซึ่งประกอบด้วยโทรโฟโซไอต์ที่โตเต็มวัย (จากระยะโทรโฟโซไอต์อะมีบอยด์) ชิซอนต์ในหลอดเลือดของอวัยวะภายใน โดยส่วนใหญ่คือสมอง รวมถึงไต ตับ ลำไส้ ไขกระดูก รก ฯลฯ
- การก่อตัวของสิ่งที่เรียกว่าโรเซตต์ ซึ่งประกอบด้วยเม็ดเลือดแดงที่ถูกบุกรุกและไม่ได้รับการติดเชื้อ
- การพัฒนาของความผิดปกติของการไหลเวียนโลหิตระดับจุลภาค เนื้อเยื่อขาดออกซิเจน กรดแลกติกในเลือดสูง (กรดแลกติกสะสมในปริมาณมาก)
- การกระตุ้นของ MFS (โดยเฉพาะอย่างยิ่งการตอบสนองของภูมิคุ้มกัน Th-1) โดยเพิ่มการสังเคราะห์ของเนื้องอกเนโครซิสแฟกเตอร์-เอ, วาย-อินเตอร์เฟอรอน, อินเตอร์ลิวคิน-1 และไซโตไคน์อื่นๆ ที่ทำลายเอนโดทีเลียมของหลอดเลือดและทำให้เม็ดเลือดแดงเกาะติดกับเอนโดทีเลียมของหลอดเลือด
ในช่วงไม่กี่ปีที่ผ่านมา มีบทบาทพิเศษของการเพิ่มขึ้นของการสังเคราะห์ไนตริกออกไซด์ (NO) โดยเซลล์เยื่อบุหลอดเลือดสมองในการพัฒนาของมาเลเรียฟัลซิปารัมในรูปแบบสมอง
กลไกทางพยาธิสรีรวิทยาที่สำคัญในการพัฒนาของมาเลเรียฟัลซิปารัมในรูปแบบที่รุนแรงเมื่อเทียบกับมาเลเรียรูปแบบอื่นคือภาวะน้ำตาลในเลือดต่ำ ซึ่งทำให้เกิดความผิดปกติของระบบไหลเวียนโลหิตและการเผาผลาญ (กรดเมตาบอลิก) ในผู้ป่วย โดยเฉพาะในเด็กและสตรีมีครรภ์ ปัจจัยหลักสามประการที่ทำให้เกิดภาวะน้ำตาลในเลือดต่ำในมาเลเรียฟัลซิปารัม ได้แก่ การสร้างกลูโคสในตับลดลง การใช้กลูโคสของปรสิต และการกระตุ้นการหลั่งอินซูลิน ในเวลาเดียวกัน ภาวะน้ำตาลในเลือดต่ำอาจเป็นผลมาจากภาวะอินซูลินในเลือดสูงที่เกิดขึ้นหลังจากการให้ควินินเพื่อหยุดการโจมตีของมาเลเรียฟัลซิปารัม
เนื่องมาจากการที่ปรสิตอยู่ในโรคมาลาเรีย-มาเลเรียเป็นเวลานาน (โดยไม่มีการบำบัดที่เหมาะสม) อาจทำให้เกิดกลุ่มอาการไตวายได้เนื่องมาจากกลไกภูมิคุ้มกัน (การสะสมของคอมเพล็กซ์ภูมิคุ้มกันที่มีแอนติเจนของปรสิตบนเยื่อฐานของไต)
ควรสังเกตว่าอาการทางคลินิกหลักของมาเลเรียทุกรูปแบบ (พิษ ตับและม้ามโต โลหิตจาง) เกี่ยวข้องกับระยะของ erythrocyte schizogony (การสืบพันธุ์แบบไม่อาศัยเพศซ้ำของปรสิตในเม็ดเลือดแดง) และยิ่งปริมาณปรสิตในเลือดของผู้ป่วย 1 μl สูงขึ้น ซึ่งกำหนดโดยกล้องจุลทรรศน์ฟิล์มเลือดหนา แสดงว่ามาเลเรียมักจะรุนแรงมากขึ้น ดังนั้นในการวินิจฉัยทางห้องปฏิบัติการของมาเลเรีย จึงมีความสำคัญไม่เพียงแค่การจำแนกประเภทของพลาสโมเดียมมาเลเรียเท่านั้น แต่ยังต้องพิจารณาระดับของปรสิตในเลือดด้วย ตามระดับสูงสุดของปรสิตในเลือด รูปแบบของมาเลเรียจะกระจายตามลำดับจากมากไปน้อย ได้แก่ มาเลเรียฟัลซิปารัม (มากถึง 100,000 ตัวใน μl หรือมากกว่า) มาเลเรียไวแวกซ์ (มากถึง 20,000 ตัวใน μl น้อยกว่านั้น) มาเลเรียโอวาเล และมาเลเรียมาเลเรียอี (มากถึง 10,000-15,000 ตัวใน μl) ในโรคมาลาเรียชนิดฟัลซิปารัม ซึ่งเกิดขึ้นโดยมีระดับปรสิตในเลือดสูง (100,000 ตัวต่อไมโครลิตรขึ้นไป) ความเสี่ยงในการเกิดภาวะแทรกซ้อนรุนแรงถึงชีวิตจะเพิ่มขึ้นอย่างมีนัยสำคัญ ซึ่งกำหนดวิธีการรักษาด้วยยาป้องกันมาลาเรียแบบเข้มข้น (ฉีดเข้าเส้นเลือด)
การเกิดไข้เฉียบพลันในมาเลเรียเกิดจากการที่เม็ดเลือดแดงแตก มีการปล่อยเมอโรโซไอต์เข้าสู่พลาสมา การทำลายบางส่วน (เมอโรโซไอต์ส่วนอื่นถูกนำเข้าสู่เม็ดเลือดแดงอีกครั้ง) การกระตุ้นของ MFS และการสังเคราะห์อินเตอร์ลิวคิน-1, -6, แฟกเตอร์เนโครซิสของเนื้องอกเอ และไพโรเจนภายในร่างกายอื่นๆ (ไซโตไคน์ที่ก่อให้เกิดการอักเสบ) ที่ส่งผลต่อศูนย์ควบคุมอุณหภูมิของไฮโปทาลามัส
หากมีพลาสโมเดียหนึ่งรุ่นในเลือด จะเกิดอาการสลับกันเป็นระยะตั้งแต่วันแรกของโรค มักเกิดกับมาเลเรียฟัลซิปารัมและมาเลเรียไวแวกซ์ (ในพื้นที่ที่มีการระบาดรุนแรงซึ่งมีการแพร่ระบาดมาเลเรียอย่างเข้มข้น) ผู้ที่ไม่ได้รับภูมิคุ้มกันจะมีอาการไข้เริ่มต้น (ไข้ขึ้น) ร่วมกับการพัฒนาของเชื้อก่อโรคหลายรุ่นในเม็ดเลือดแดงของผู้ป่วยพร้อมๆ กัน โดยใช้เวลาต่างกันในช่วงท้ายของวงจรการพัฒนา ทำให้เกิดการโจมตีแบบเป็นชั้นๆ ทำให้ระยะเวลาของอาการไข้กำเริบราบรื่นขึ้น และอาการกำเริบแบบปกติจะผิดเพี้ยนไป
ในขณะที่โรคพัฒนาขึ้น ปัจจัยป้องกันที่จำเพาะและไม่จำเพาะจะเพิ่มขึ้น (เมื่อสิ้นสุดสัปดาห์ที่ 1-2) โรคบางรุ่นจะตายไป และปรสิตรุ่นชั้นนำหนึ่ง (สอง) รุ่นจะยังคงอยู่โดยมีอาการชักกระตุกแบบปกติทุกๆ วันเว้นวัน (หรือทุกวัน)
ภาวะตับและม้ามโตในมาลาเรียทุกประเภทมีความเกี่ยวข้องกับการเติมเลือด อาการบวมน้ำ และการเพิ่มจำนวนของข้อที่แพร่กระจาย
โดยทั่วไปแล้วมาเลเรียจะทำให้เกิดภาวะโลหิตจางจากเม็ดเลือดแดงแตก ซึ่งการเกิดโรคมีปัจจัยสำคัญหลายประการ ดังนี้
- การแตกของเม็ดเลือดแดงที่ติดเชื้อภายในหลอดเลือด
- การจับกินเม็ดเลือดแดงทั้งที่ติดเชื้อและไม่ติดเชื้อโดยเซลล์เรติคูโลเอนโดทีเลียมของม้าม
- การสะสมของเม็ดเลือดแดงที่มีปรสิตที่โตเต็มที่ในไขกระดูก การยับยั้งการสร้างเม็ดเลือด
- กลไกภูมิคุ้มกัน (การทำลายเม็ดเลือดแดงที่ไม่ได้รับผลกระทบเนื่องจากการดูดซับของคอมเพล็กซ์ภูมิคุ้มกันที่มีส่วนประกอบ C-3 ของส่วนประกอบบนเยื่อหุ้มเม็ดเลือดแดง)
ระยะ gametocytogony เป็นสาขาหนึ่งของระยะ ES เมอโรโซอิตบางส่วน (กระบวนการที่กำหนดทางพันธุกรรม) แทนที่จะทำซ้ำวงจรการพัฒนาแบบไม่อาศัยเพศหลังจากถูกนำเข้าไปในเม็ดเลือดแดง กลับกลายเป็นรูปแบบที่อาศัยเพศ - gametocytes (ตัวผู้และตัวเมีย)
ลักษณะเด่นของระยะ gametocytogonial ในมาเลเรียฟัลซิปารัม:
- เซลล์สืบพันธุ์ปรากฏในเลือดส่วนปลายไม่เร็วกว่า 10-12 วันของการเจ็บป่วย
- เซลล์สืบพันธุ์เพศผู้ที่สะสมในระหว่างการดำเนินโรคสามารถหมุนเวียนอยู่ในกระแสเลือดได้เป็นเวลานาน (นานถึง 4-6 สัปดาห์หรือมากกว่านั้น)
ในมาเลเรียชนิดอื่นๆ เช่น vivax, ovale, malariae สามารถตรวจพบแกมีโทไซต์ได้ในเลือดส่วนปลายตั้งแต่วันแรกของโรค และจะตายอย่างรวดเร็ว (ภายในเวลาไม่กี่ชั่วโมงถึงไม่กี่วัน)
อาการ มาลาเรีย
เมื่อพิจารณาจากลักษณะเฉพาะของชนิดของปรสิตมาเลเรียและอาการของโรคมาเลเรียที่สอดคล้องกัน โรคนี้จึงแบ่งออกเป็น 4 รูปแบบ คือ มาเลเรียสามวัน (vivax-malaria, malaria tertiana), มาเลเรียสี่วัน (malaria quartana), มาเลเรียเขตร้อน (falciparum-malaria, malaria tropica) และมาเลเรียรูปไข่สามวัน (ovale-malaria)
ระยะของโรคมาลาเรียขั้นต้นประกอบด้วยช่วงเริ่มต้นของโรค ช่วงที่โรคถึงจุดสูงสุดและช่วงฟื้นตัว หากไม่ได้รับการรักษาหรือใช้ยารักษาที่ไม่เหมาะสม โรคมาลาเรียจะเข้าสู่ช่วงที่โรคกำเริบอีกครั้ง โดยโรคมาลาเรียจะกำเริบแบบนอกเม็ดเลือดแดงและแบบเม็ดเลือดแดง ขึ้นอยู่กับระยะเวลาที่โรคกำเริบ ซึ่งได้แก่ ระยะเริ่มต้นและระยะท้าย โรคมาลาเรียกำเริบแบบเม็ดเลือดแดงมักพบในผู้ที่ติดเชื้อพลาสโมเดียมทุกประเภท โดยระยะแรกจะเกิดขึ้นภายใน 2 เดือนหลังจากการโจมตีครั้งแรก ส่วนระยะกำเริบที่เกิดขึ้นในภายหลังจะถือว่าระยะท้าย หากไม่ได้รับการรักษาหรือรักษามาลาเรียชนิดสามวันและชนิดไข่ไม่ถูกวิธี โรคจะ "สงบลง" เป็นเวลา 6-11 เดือน โดยปรสิตจะหายไปจากเลือดและอาการทางคลินิกจะหายไป จากนั้นโรคจะกลับมากำเริบในภายหลัง (เกิดจากการกระตุ้นฮิปโนโซอิตในตับ) และจะถูกแทนที่ด้วยระยะแฝงโดยไม่ได้รับการรักษา หลังจากนั้นโรคจะกลับมาเป็นซ้ำอีก

P. falciparum อาศัยอยู่ในร่างกายมนุษย์ (โดยไม่ต้องรักษา) ได้นานถึง 1.5 ปี, P. vivax และ P. ovale ได้นานถึง 3 ปี, P. malariae ได้นานหลายปี บางครั้งตลอดชีวิต
สิ่งที่รบกวนคุณ?
รูปแบบ
ตามคำแนะนำขององค์การอนามัยโลก โรคมาลาเรียแบ่งออกเป็นโรคไม่ซับซ้อน โรครุนแรง และโรคแทรกซ้อน โรคมาลาเรียชนิดร้ายแรงและภาวะแทรกซ้อนมักเกิดจากการติดเชื้อ P. falciparum โรคที่เกิดจาก P. vivax, P. ovale และ P. malariae มักไม่รุนแรง
โรคมาเลเรีย 3 วัน
ระยะฟักตัวของมาเลเรีย 3 วันคือ 10-21 วันถึง 6-14 เดือน อาการเริ่มต้นของมาเลเรียก่อนการโจมตีครั้งแรกนั้นพบได้น้อยครั้ง แต่ส่วนใหญ่มักจะเกิดขึ้นก่อนที่โรคจะกลับมาเป็นซ้ำ โดยแสดงออกมาด้วยความรู้สึกไม่สบายทั่วร่างกาย อ่อนแรง อ่อนเพลีย ปวดบริเวณเอวและแขนขา อุณหภูมิร่างกายสูงขึ้นเล็กน้อย เบื่ออาหาร ปวดศีรษะ ระยะเริ่มต้นโดยเฉลี่ยคือ 1-5 วัน
ในระยะแรกเส้นโค้งอุณหภูมิจะไม่สม่ำเสมอ (ไข้เริ่มต้น) ซึ่งสัมพันธ์กับการปลดปล่อย P. vivax หลายรุ่นเข้าสู่กระแสเลือดแบบไม่พร้อมกัน ต่อมา การโจมตีของมาเลเรียทั่วไปเริ่มต้นด้วยไข้สามวันเป็นระยะๆ ซึ่งบ่งชี้ถึงการก่อตัวของปรสิตรุ่นหลักในเลือด การโจมตีของมาเลเรียด้วยไข้จะแสดงอาการทางคลินิกสามระยะอย่างชัดเจน ซึ่งตามมาทันที ได้แก่ ระยะหนาวสั่น ความร้อน และเหงื่อ การโจมตีของมาเลเรียเริ่มต้นด้วยอาการหนาวสั่น ความรุนแรงอาจแตกต่างกันไป ตั้งแต่สั่นเล็กน้อยไปจนถึงหนาวสั่นจนแทบหายใจไม่ออก ในเวลานี้ ผู้ป่วยเข้านอน พยายามทำให้ร่างกายอบอุ่นขึ้นแต่ไม่สำเร็จ แต่ความหนาวสั่นจะเพิ่มขึ้น ผิวหนังจะแห้ง หยาบ หรือ "เหมือนขนลุก" เมื่อสัมผัส เย็น ปลายแขนปลายขาและเยื่อเมือกที่มองเห็นได้เป็นสีเขียว อาการของโรคมาเลเรียมีดังนี้ ปวดศีรษะรุนแรง บางครั้งอาเจียน ปวดข้อและบริเวณเอว ระยะหนาวสั่นจะกินเวลานานหลายนาทีจนถึง 1-2 ชั่วโมง และจะถูกแทนที่ด้วยระยะไข้ ผู้ป่วยถอดเสื้อผ้าและชุดชั้นในออก แต่ก็ไม่ได้บรรเทาลง อุณหภูมิร่างกายสูงถึง 40-41 °C ผิวแห้งและร้อน ใบหน้าแดง ปวดหัว ปวดบริเวณเอวและข้อมากขึ้น อาจมีอาการเพ้อคลั่งและสับสน ระยะไข้กินเวลาตั้งแต่ 1 ถึงหลายชั่วโมง และถูกแทนที่ด้วยช่วงเหงื่อออก อุณหภูมิลดลงอย่างวิกฤต เหงื่อออกมากบ่อยครั้ง ดังนั้นผู้ป่วยจึงต้องเปลี่ยนชุดชั้นในซ้ำๆ เมื่ออาการกำเริบ ผู้ป่วยจะหลับไปในไม่ช้า ระยะเวลาของอาการกำเริบคือ 6-10 ชั่วโมง อาการของโรคเริ่มในตอนเช้าและตอนบ่ายถือเป็นเรื่องปกติ หลังจากอาการกำเริบ จะเริ่มมีไข้เป็นระยะนานประมาณ 40 ชั่วโมง หลังจากอาการกำเริบ 2-3 ครั้ง ตับและม้ามจะโตขึ้นอย่างเห็นได้ชัด การเปลี่ยนแปลงในเลือด: ภาวะโลหิตจางซึ่งค่อย ๆ เกิดขึ้นตั้งแต่สัปดาห์ที่สองของโรค, ภาวะเม็ดเลือดขาวต่ำ, ภาวะเม็ดเลือดขาวชนิดนิวโทรฟิลต่ำพร้อมกับการเลื่อนของเซลล์แถบไปทางด้านซ้าย, ภาวะลิมโฟไซต์สูง, ภาวะโลหิตจางจากเม็ดเลือดขาวชนิดอื่น และ ESR สูงขึ้น
ตามแนวทางธรรมชาติของโรคโดยไม่มีการรักษาสาเหตุ หลังจากการโจมตี 12-14 ครั้ง (4-6 สัปดาห์) ความรุนแรงของไข้จะลดลง การโจมตีจะค่อยๆ ลดลง ขนาดของตับและม้ามลดลง อย่างไรก็ตาม หลังจาก 2 สัปดาห์ถึง 2 เดือน อาการกำเริบในระยะเริ่มต้นจะเกิดขึ้น โดยมีลักษณะคือเส้นโค้งอุณหภูมิที่ซิงโครไนซ์กัน ตับและม้ามเพิ่มขึ้น และภาวะโลหิตจาง ต่อมา เมื่อภูมิคุ้มกันเพิ่มขึ้น ปรสิตจะหายไปจากเลือดและเริ่มมีระยะแฝง หากไม่ได้รับการรักษาด้วยยาฮิสโตสคิโซทรอปิกในช่วงเวลานี้ หลังจาก 6-8 เดือน (และบางครั้งหลังจาก 1-3 ปี) ปรสิตในรูปแบบเนื้อเยื่อ "หลับใหล" จะทำงานและเกิดอาการกำเริบในระยะห่างไกล ลักษณะเฉพาะคืออาการเฉียบพลัน อาการไม่รุนแรง ม้ามเพิ่มขึ้นในระยะเริ่มต้น การโจมตีจำนวนน้อย (มากถึง 7-8 ครั้ง) ความรุนแรงและระยะเวลาของปรสิตในเลือดน้อยลง มีเซลล์สืบพันธุ์ในเลือด
มาลาเรียชนิดโอวาเล่
มาลาเรียชนิด Ovale มีลักษณะทางคลินิกและทางพยาธิวิทยาหลายประการที่คล้ายคลึงกับมาลาเรียชนิด vivax ในระยะสามวัน ระยะฟักตัวของมาลาเรียชนิด Ovale คือ 11-16 วัน สำหรับมาลาเรียชนิด Ovale เชื้อก่อโรคมีแนวโน้มที่จะแฝงตัวในระยะเริ่มต้น ระยะฟักตัวอาจกินเวลาตั้งแต่ 2 เดือนถึง 2 ปีหรือมากกว่านั้น อาการของโรคมาลาเรีย ได้แก่ มีไข้เป็นระยะๆ เป็นเวลาสามวัน แต่ไม่ค่อยเป็นทุกวัน มักมีไข้ในช่วงเย็นมากกว่าช่วงเช้าตรู่เหมือนอย่างมาลาเรียชนิดอื่นๆ มาลาเรียชนิด Ovale มีลักษณะเฉพาะคือมีอาการไม่รุนแรง มีไข้กำเริบเล็กน้อยโดยไม่มีอาการหนาวสั่นชัดเจน และมีอุณหภูมิร่างกายต่ำในช่วงที่อาการกำเริบ ลักษณะเฉพาะคือ ไข้กำเริบในช่วงที่อาการกำเริบในระยะเริ่มต้นมักจะหยุดลงเอง ซึ่งอธิบายได้จากการสร้างภูมิคุ้มกันที่เสถียรอย่างรวดเร็ว หากไม่ได้รับการรักษาด้วยยาฮิสโตสคิโซทรอปิก อาจเกิดอาการกำเริบได้ 1-3 ครั้ง โดยมีช่วงเวลาการกำเริบระหว่าง 17 วันถึง 7 เดือน
ควอร์ตัน
โดยทั่วไปอาการจะดำเนินไปอย่างไม่เป็นอันตราย ระยะฟักตัวอยู่ที่ 3 ถึง 6 สัปดาห์ อาการเริ่มต้นของโรคมาลาเรียพบได้น้อย อาการของโรคจะเฉียบพลัน จากการโจมตีครั้งแรก ไข้จะขึ้นเป็นระยะ ๆ โดยมีอาการกำเริบเป็นระยะ ๆ ทุก ๆ 2 วัน อาการกำเริบมักเริ่มในตอนเที่ยง โดยเฉลี่ยจะกินเวลาประมาณ 13 ชั่วโมง ช่วงเวลาของอาการหนาวสั่นจะยาวนานและชัดเจน ช่วงเวลาของอาการร้อนจะกินเวลานานถึง 6 ชั่วโมง มีอาการปวดหัว ปวดเมื่อยกล้ามเนื้อ ปวดข้อ บางครั้งคลื่นไส้ อาเจียน บางครั้งผู้ป่วยจะกระสับกระส่ายและเพ้อคลั่ง ในระยะชัก อาการของผู้ป่วยจะน่าพอใจ ภาวะโลหิตจาง ตับและม้ามโตจะค่อยๆ พัฒนาช้าๆ - ไม่เร็วกว่า 2 สัปดาห์หลังจากเริ่มมีอาการของโรค หากไม่ได้รับการรักษา จะพบอาการ 8-14 ครั้ง แต่กระบวนการของเม็ดเลือดแดงแตกในระดับต่ำจะคงอยู่เป็นเวลาหลายปี ส่วนใหญ่การติดเชื้อมักเกิดขึ้นในรูปแบบของพาหะของปรสิตโดยไม่มีการกระตุ้นการทำงานของเม็ดเลือดแดงแบบแยกส่วน ซึ่งทำให้บุคคลดังกล่าวอาจเป็นผู้บริจาคที่อันตรายได้ ในจุดโฟกัสของโรคประจำถิ่น มาเลเรีย 4 วันทำให้เกิดกลุ่มอาการไตวายซึ่งมีการพยากรณ์โรคที่ไม่ดีในเด็ก
มาเลเรียเขตร้อน
การติดเชื้อมาเลเรียที่รุนแรงที่สุด ระยะฟักตัวคือ 8-16 วัน เมื่อสิ้นสุดระยะนี้ ผู้ที่ไม่ได้รับภูมิคุ้มกันบางรายจะมีอาการเริ่มต้นของมาเลเรียซึ่งกินเวลานานตั้งแต่หลายชั่วโมงจนถึง 1-2 วัน ได้แก่ อ่อนแรง อ่อนล้า ปวดเมื่อยตามตัว ปวดเมื่อยกล้ามเนื้อและข้อ ปวดศีรษะ ในผู้ป่วยส่วนใหญ่ มาเลเรียเขตร้อนจะเริ่มขึ้นอย่างเฉียบพลันโดยไม่มีระยะเริ่มต้น โดยอุณหภูมิร่างกายจะสูงขึ้นถึง 38-39 องศาเซลเซียส หากวงจรของอาการไข้แบบแยกตัวในเชื้อ P. falciparum หลายรุ่นในสิ่งมีชีวิตที่ติดเชื้อไม่สิ้นสุดพร้อมกัน อาการนี้มักแสดงทางคลินิกโดยที่ไม่มีอาการไข้เป็นวัฏจักรเป็นระยะๆ อาการกำเริบซึ่งเกิดขึ้นพร้อมกับการเปลี่ยนระยะสลับกัน เริ่มต้นด้วยอาการหนาวสั่นนาน 30 นาทีถึง 1 ชั่วโมง ในช่วงเวลานี้ ผิวหนังจะซีดเมื่อตรวจดู เย็นเมื่อสัมผัส มักมีอาการหยาบกร้านคล้าย "ขนลุก" อาการหนาวสั่นจะมาพร้อมกับอุณหภูมิร่างกายที่สูงขึ้นถึง 38-39 °C เมื่ออาการหนาวสั่นหยุดลง ระยะที่สองของอาการกำเริบจะเริ่มขึ้น - ไข้ ผู้ป่วยจะรู้สึกอุ่นเล็กน้อย บางครั้งอาจรู้สึกร้อนจริง ๆ ผิวหนังจะร้อนเมื่อสัมผัส ใบหน้ามีเลือดคั่ง ระยะนี้กินเวลาประมาณ 12 ชั่วโมง จากนั้นจะถูกแทนที่ด้วยเหงื่อออกเล็กน้อย อุณหภูมิร่างกายลดลงสู่ระดับปกติและต่ำกว่าปกติ และหลังจากนั้น 1-2 ชั่วโมง อุณหภูมิร่างกายจะเพิ่มขึ้นอีกครั้ง ในบางกรณี การเริ่มต้นของมาเลเรียเขตร้อนจะมาพร้อมกับอาการคลื่นไส้ อาเจียน ท้องเสีย บางครั้งอาจมีอาการหวัดจากมาเลเรียจากทางเดินหายใจส่วนบน เช่น ไอ น้ำมูกไหล เจ็บคอ ในระยะต่อมา ผู้ป่วยจะสังเกตเห็นผื่นเริมที่ริมฝีปากและปีกจมูก ในระยะเฉียบพลัน ผู้ป่วยจะสังเกตเห็นอาการเยื่อบุตาแดง ในกรณีที่รุนแรงของโรค อาจมาพร้อมกับอาการจุดเลือดออกใต้เยื่อบุตาหรือเลือดออกใต้เยื่อบุตาขนาดใหญ่
ในช่วงที่โรคมาลาเรียเขตร้อนรุนแรงที่สุด อาการหนาวสั่นจะไม่เด่นชัดเท่ากับในช่วงวันแรกๆ ของโรค โดยอาการจะกินเวลาประมาณ 15-30 นาที ไข้จะคงอยู่เป็นเวลาหลายวัน และไม่ค่อยพบอาการไข้สูงเป็นระยะๆ ในระยะเริ่มต้นของโรค อุณหภูมิร่างกายจะสูงสุดที่ 38.5 องศาเซลเซียส โดยไข้จะกินเวลานาน 3-4 วัน ส่วนระดับความรุนแรงปานกลางจะอยู่ที่ 39.5 องศาเซลเซียส และ 6-7 วันตามลำดับ ส่วนระดับความรุนแรงของโรคจะอยู่ที่ 40 องศาเซลเซียสขึ้นไป และกินเวลานาน 8 วันขึ้นไป ระยะเวลาของอาการกำเริบเป็นพักๆ (และบางครั้งอาจเกิดหลายอาการพร้อมกัน) ในมาลาเรียเขตร้อนจะอยู่ที่ 30-40 ชั่วโมง โดยอาการอุณหภูมิจะมีลักษณะไม่สม่ำเสมอและหายไปเป็นพักๆ บ่อยครั้ง
ตับโตมักจะตรวจพบในวันที่ 3 ของโรค ม้ามโต - ตั้งแต่วันที่ 3 เช่นกัน แต่โดยปกติจะบันทึกได้ด้วยการเคาะเท่านั้น การคลำที่ชัดเจนจะเกิดขึ้นได้ในวันที่ 5-6 เท่านั้น ระหว่างการตรวจอัลตราซาวนด์ของอวัยวะในช่องท้อง ตับและม้ามโตจะถูกตรวจพบในวันที่ 2-3 หลังจากอาการทางคลินิกของมาเลเรียเขตร้อนปรากฏขึ้น ความผิดปกติของการเผาผลาญเม็ดสีจะสังเกตได้เฉพาะในผู้ป่วยที่เป็นมาเลเรียเขตร้อนที่รุนแรงและปานกลาง (แต่พบไม่บ่อยนัก) กิจกรรมของเอนไซม์อะมิโนทรานสเฟอเรสในซีรั่มที่เพิ่มขึ้นมากกว่าสามเท่าถือเป็นตัวบ่งชี้การพยากรณ์โรคที่ไม่พึงประสงค์ ความผิดปกติของการเผาผลาญในมาเลเรียเขตร้อนรวมถึงการเปลี่ยนแปลงในระบบการหยุดเลือดและภาวะน้ำตาลในเลือดต่ำ ความผิดปกติของหลอดเลือดและหัวใจมีลักษณะการทำงานและแสดงออกโดยหัวใจเต้นเร็ว เสียงหัวใจที่อู้อี้ และความดันโลหิตต่ำ บางครั้งอาจได้ยินเสียงหัวใจเต้นผิดจังหวะชั่วคราวที่จุดสูงสุดของหัวใจ ในรูปแบบที่รุนแรงของโรค การเปลี่ยนแปลงของคลื่นไฟฟ้าหัวใจจะสังเกตเห็นในรูปแบบของการผิดรูปของส่วนปลายของคอมเพล็กซ์โพรงหัวใจ: คลื่น T แบนลงและการกำหนดค่าย้อนกลับ คลื่น ST ลดลง ในเวลาเดียวกัน แรงดันไฟฟ้าของคลื่น R ในลีดมาตรฐานจะลดลง ในผู้ป่วยที่มีรูปแบบสมอง การเปลี่ยนแปลงของคลื่น P จะเป็นแบบ P-pulmonale
ในโรคมาลาเรียเขตร้อน มักพบอาการผิดปกติของระบบประสาทส่วนกลางร่วมกับอาการไข้สูงและพิษ ได้แก่ ปวดศีรษะ อาเจียน เยื่อหุ้มสมองเกร็ง ชัก ง่วงนอน บางครั้งมีอาการคล้ายอาการเพ้อ แต่ผู้ป่วยยังมีสติสัมปชัญญะอยู่
อาการเด่นของการติดเชื้อมาลาเรียระดับปานกลางและรุนแรง ได้แก่ ภาวะโลหิตจางจากเม็ดเลือดแดงแตกและภาวะเม็ดเลือดขาวต่ำ อีโอซิโนฟิลและนิวโทรฟิลต่ำ โดยพบลิมโฟไซต์สูงในสูตรของเม็ดเลือดขาว ในผู้ป่วยโรคร้ายแรง อาจพบภาวะเม็ดเลือดขาวสูงเนื่องจากนิวโทรฟิล โดย ESR จะสูงขึ้นอย่างต่อเนื่องและชัดเจน ภาวะเกล็ดเลือดต่ำเป็นสัญญาณที่พบได้บ่อยในมาลาเรียทุกประเภท เช่นเดียวกับโรคติดเชื้ออื่นๆ ผู้ป่วยจะพบโปรตีนในปัสสาวะชั่วคราว
โรคมาเลเรียเขตร้อนที่กลับมาเป็นซ้ำเกิดจากการรักษาที่ไม่เหมาะสมหรือการดื้อยาของเชื้อ P. falciparum ต่อยาเคมีบำบัดที่ใช้ โรคมาเลเรียเขตร้อนตามธรรมชาติจะดำเนินไปไม่เกิน 2 สัปดาห์ หากไม่ได้รับการบำบัดที่ได้ผล โรคจะกลับมาเป็นซ้ำอีกหลังจาก 7-10 วัน
การตั้งครรภ์เป็นปัจจัยเสี่ยงที่ยอมรับกันโดยทั่วไปสำหรับมาเลเรียเขตร้อน เนื่องมาจากการตั้งครรภ์มีอุบัติการณ์สูงขึ้น แนวโน้มที่จะเกิดอาการทางคลินิกที่รุนแรง ความเสี่ยงต่อสุขภาพและชีวิตของเด็ก และคลังยารักษาที่จำกัด มาเลเรียเขตร้อนในเด็กอายุต่ำกว่า 5 ปีควรได้รับการพิจารณาว่าเป็นโรคที่อาจถึงแก่ชีวิต ในเด็กกลุ่มอายุน้อยกว่า (ไม่เกิน 3-4 ปี) โดยเฉพาะในทารก มาเลเรียมีภาพทางคลินิกที่ไม่เหมือนใคร: ไม่มีอาการทางคลินิกที่เด่นชัดที่สุด - การเป็นมาเลเรียแบบเฉียบพลัน ในขณะเดียวกัน อาการของมาเลเรีย เช่น ชัก อาเจียน ท้องเสีย ปวดท้อง ก็สังเกตได้ โดยอาการของเด็กจะแย่ลงอย่างรวดเร็ว การชักและอาการทางสมองอื่นๆ ไม่ได้หมายความว่าเป็นมาเลเรียในสมองเสมอไป ซึ่งมักเป็นหนึ่งในอาการของพิษต่อระบบประสาท การติดเชื้อปรสิตในเด็กเล็กมักจะสูง: P. falciparum สามารถส่งผลต่อเซลล์เม็ดเลือดแดงได้มากถึง 20% โรคดังกล่าวอาจกลายเป็นมะเร็งอย่างรวดเร็วและอาจทำให้เด็กเสียชีวิตได้
ภาวะแทรกซ้อนและผลกระทบ
พบเชื้อมาลาเรียทุกระยะในเขตร้อน อาการของโรคมาลาเรียที่มีแนวโน้มไม่ดี บ่งชี้ถึงความเป็นไปได้ที่จะพัฒนาเป็นมาลาเรียชนิดร้ายแรง - มีไข้ทุกวัน ไม่มีไข้ระหว่างการโจมตี ปวดศีรษะรุนแรง ชักกระตุกทั่วไปซ้ำมากกว่า 2 ครั้งใน 24 ชั่วโมง สมองแข็ง ช็อกจากการไหลเวียนเลือด (ความดันโลหิตซิสโตลิกต่ำกว่า 70 มม. ปรอทในผู้ใหญ่ และต่ำกว่า 50 มม. ปรอทในเด็ก) นอกจากนี้ยังพบเชื้อมาลาเรียในเลือดสูง (เชื้อ P. falciparum มากกว่า 100,000 ตัวในเลือด 1 ไมโครลิตร) ตรวจพบเชื้อมาลาเรียในระยะต่างๆ ของอายุในเลือดส่วนปลาย มีเซลล์สืบพันธุ์ เม็ดเลือดขาวเพิ่มขึ้น (มากกว่า 12.0x10 9 /ลิตร) ภาวะน้ำตาลในเลือดต่ำน้อยกว่า 2.2 มิลลิโมลต่อลิตร กรดเมตาโบลิกเสื่อมลง กิจกรรมของอะมิโนทรานสเฟอเรสในซีรั่มเพิ่มขึ้นมากกว่าสามเท่า รวมทั้งระดับกลูโคสในน้ำไขสันหลังลดลง และระดับแลคเตตมากกว่า 6 ไมโครโมลต่อลิตร ก็มีแนวโน้มว่าจะไม่เป็นผลดีเช่นกัน
โรคทางระบบประสาทส่วนกลางที่รุนแรงในมาลาเรียเขตร้อนจะเรียกรวมกันว่า "มาลาเรียในสมอง" โดยอาการหลักคืออาการโคม่า อาการโคม่าจากมาลาเรียอาจเป็นภาวะแทรกซ้อนของมาลาเรียชนิดปฐมภูมิ มาลาเรียซ้ำ และมาลาเรียที่กลับมาเป็นซ้ำ แต่พบได้บ่อยในมาลาเรียชนิดปฐมภูมิ โดยเฉพาะในเด็ก สตรีมีครรภ์ เยาวชน และวัยกลางคน
รูปแบบของสมองเป็นภาวะแทรกซ้อนที่พบบ่อยที่สุดของมาเลเรียฟัลซิปารัมที่รุนแรง ในสภาวะปัจจุบัน รูปแบบของสมองพัฒนาขึ้นใน 10% ของผู้ป่วยมาเลเรียฟัลซิปารัมทั้งหมดทั่วโลก และ 60-80% ของผลลัพธ์ที่ร้ายแรงทั้งหมดของโรคมีความเกี่ยวข้องกับภาวะแทรกซ้อนนี้ รูปแบบของสมองสามารถพัฒนาขึ้นได้ตั้งแต่วันแรก แต่ส่วนใหญ่มักจะเกิดขึ้นในสัปดาห์ที่ 2 ของโรคเนื่องจากไม่มีการรักษาที่เฉพาะเจาะจงหรือไม่เพียงพอ ผลลัพธ์ที่ร้ายแรงอาจเกิดขึ้นภายใน 1-2 วัน ในภาพทางคลินิกของมาเลเรียในสมอง แบ่งได้เป็น 3 ช่วงเวลา ได้แก่ มึนงง มึนงง และโคม่าอย่างแท้จริง
ระยะมึนงง ผู้ป่วยจะมีอาการซึมทั้งทางร่างกายและจิตใจ อ่อนเพลียอย่างรวดเร็ว ผู้ป่วยจะปรับเวลาและสถานที่ได้เอง แต่ยังคงติดต่อสื่อสารอย่างไม่เต็มใจ ตอบคำถามด้วยพยางค์เดียว เหนื่อยง่าย ปฏิกิริยาตอบสนองของเอ็นยังคงอยู่
ระยะหลับสนิทจะแสดงอาการโดยผู้ป่วยนอนราบลงอย่างแรงพร้อมกับมีสติชั่วคราวเป็นครั้งคราว อาจมีอาการอะแท็กเซีย ความจำเสื่อม ชักกระตุก ซึ่งบางครั้งอาจมีอาการคล้ายโรคลมบ้าหมูได้ รีเฟล็กซ์ของกระจกตายังคงอยู่ รูม่านตาปกติ รีเฟล็กซ์ของเอ็นเพิ่มขึ้น และเกิดรีเฟล็กซ์ผิดปกติ
ในอาการโคม่า ผู้ป่วยจะหมดสติและไม่ตอบสนองต่อสิ่งเร้าภายนอก สังเกตอาการผิดปกติของการบรรจบกัน ตาเหล่แยกออกจากกัน ลูกตาเคลื่อนไหวลอยตัวพร้อมเปลือกตาเปิด (ราวกับว่าผู้ป่วยกำลังมองดูเพดาน) ตาสั่นในแนวนอนและแนวตั้ง อัมพาตของเส้นประสาทสมองคู่ที่ 6 การตอบสนองของเอ็นและช่องท้องหายไป การทำงานของระบบสืบพันธุ์ลดลงอย่างมาก มีอาการเยื่อหุ้มสมองของมาเลเรียและการตอบสนองทางพยาธิวิทยาของบาบินสกี้ รอสโซลิโม ฯลฯ สังเกตอาการกลั้นปัสสาวะและอุจจาระไม่อยู่ การเจาะน้ำไขสันหลังเผยให้เห็นความดันในกะโหลกศีรษะที่เพิ่มขึ้นโดยไม่มีการรบกวนที่ชัดเจนในองค์ประกอบของโปรตีนและเซลล์ของน้ำไขสันหลัง ตรวจพบเชื้อ P. falciparum ในระดับสูงตามช่วงอายุต่างๆ โดยหยดเลือดที่หนาและสเปรดเลือดของผู้ป่วยที่เป็นมาเลเรียในภาวะโคม่า ในเวลาเดียวกัน มีรายงานกรณีการเสียชีวิตจากมาลาเรียในสมองโดยมีปรสิตในเลือดในระดับต่ำมาก มาลาเรียในสมองในเด็กมักมาพร้อมกับภาวะโลหิตจาง ภาวะโลหิตจางทำให้สภาพทางระบบประสาทและร่างกายของเด็กแย่ลง หากได้รับการรักษาอย่างมีประสิทธิภาพ มักจะรู้สึกตัวได้ทันที
ในโรคมาลาเรียในสมอง อาการทางจิตอาจเกิดขึ้นจากการเปลี่ยนแปลงของเนื้อเยื่อสมองที่ผิดปกติ ในระยะเฉียบพลัน อาการทางจิตจะเกิดขึ้นในรูปแบบของอาการเพ้อคลั่ง อาการสมองเสื่อม อาการชัก และอาการคลั่งไคล้ อาการทางจิตหลังโรคมาลาเรียมีลักษณะเฉพาะคือ ภาวะซึมเศร้า จิตใจอ่อนแอ ฮิสทีเรีย อาการคล้ายโรคจิตเภท และในเด็ก พัฒนาการทางจิตใจล่าช้าชั่วคราว บางครั้งอาจพบผลที่ตามมาในระยะยาวของมาลาเรียในสมอง เช่น อัมพาตครึ่งซีก อาการอะแท็กเซีย อาการเฉพาะที่ของเส้นประสาทสมอง ความผิดปกติของระบบนอกพีระมิด เส้นประสาทอักเสบทั้งแบบโมโนและโพลี
ภาวะแทรกซ้อนที่พบบ่อยของการติดเชื้อมาเลเรียทุกรูปแบบคือภาวะโลหิตจางจากภาวะสีซีดผิดปกติ ภาวะโลหิตจางรุนแรงจะวินิจฉัยได้เมื่อค่าฮีมาโตคริตลดลงต่ำกว่า 20% และระดับฮีโมโกลบินต่ำกว่า 50 กรัมต่อลิตร ระดับของภาวะโลหิตจางขึ้นอยู่กับชนิดของปรสิต รวมถึงความรุนแรงและระยะเวลาของการติดเชื้อ ความรุนแรงของโรคมาเลเรียในชนพื้นเมืองในประเทศเขตร้อนมักจะรุนแรงขึ้นเนื่องจากการขาดธาตุเหล็กและกรดโฟลิกในอาหาร หลังจากโรคมาเลเรียกำเริบครั้งแรก อาจเกิดภาวะโลหิตจางได้ ซึ่งอาการจะรุนแรงขึ้นในมาเลเรียเขตร้อนมากกว่าในรูปแบบอื่นๆ
ภาวะช็อกจากสารพิษติดเชื้อ (ITS) ร่วมกับการเกิดกลุ่มอาการ DIC เป็นภาวะแทรกซ้อนที่เป็นลักษณะเฉพาะของมาลาเรีย-ฟัลซิรา ซึ่งมักเกิดขึ้นพร้อมกับปรสิตจำนวนมาก การเกิดภาวะต่อมหมวกไตทำงานไม่เพียงพอเฉียบพลันเป็นลักษณะเฉพาะ ภาวะช็อกจากสารพิษติดเชื้อในสภาพอากาศร้อนมักมาพร้อมกับภาวะเลือดจาง
การพัฒนาของภาวะไตวายเฉียบพลันมักพบในมาเลเรียฟัลซิปารัมที่เป็นมะเร็งและมีอาการแทรกซ้อน การพัฒนาของภาวะปัสสาวะน้อยและปัสสาวะไม่ออกร่วมกับการเพิ่มขึ้นของครีเอตินินและยูเรียในเลือดเป็นลักษณะเฉพาะ การวิเคราะห์ปัสสาวะเผยให้เห็นโปรตีนในปัสสาวะ ไซลินดรูเรีย หนองในปัสสาวะ และไมโครฮีมาเลเรียอย่างชัดเจน
โรคไตเป็นภาวะแทรกซ้อนที่เป็นเอกลักษณ์ของโรคมาลาเรีย มีลักษณะอาการที่ดำเนินไปอย่างช้าๆ และค่อยเป็นค่อยไป โดยมีอาการบวมน้ำ ความดันโลหิตสูง โปรตีนในปัสสาวะ และการเกิดไตวายร่วมด้วย
ไข้ฮีโมโกลบินในกระแสเลือดเป็นผลจากการแตกของเม็ดเลือดแดงในหลอดเลือดอย่างรุนแรงทั้งจากการบุกรุกอย่างรุนแรงและจากการใช้ยาต้านมาลาเรียบางชนิด (ควินิน พรีมาควิน ซัลโฟนาไมด์) ในบุคคลที่มีเอนไซม์กลูโคส-6-ฟอสเฟตดีไฮโดรจีเนสบกพร่อง ในรูปแบบที่รุนแรงจะมีอาการดีซ่านรุนแรง กลุ่มอาการเลือดออกรุนแรง โลหิตจาง และปัสสาวะไม่ออก ร่วมกับอาการหนาวสั่น มีไข้ (40 °C) ปวดบริเวณเอว อาเจียนน้ำดีซ้ำๆ ปวดเมื่อยกล้ามเนื้อ ปวดข้อ ปัสสาวะมีสีน้ำตาลเข้ม ซึ่งเกิดจากการมีออกซีฮีโมโกลบิน จำนวนเม็ดเลือดแดงในรายที่รุนแรงจะลดลงเหลือ 1x10 12 /l และระดับฮีโมโกลบินลดลงเหลือ 20-30 g /l มีปรสิตในเลือดเพียงเล็กน้อยที่มีฮีโมโกลบินในกระแสเลือดเนื่องจากมาลาเรียหรือตรวจไม่พบเลย การหยุดยาป้องกันมาเลเรียอย่างรวดเร็ว ซึ่งทำให้เม็ดเลือดแดงแตก อาการของผู้ป่วยจะดีขึ้นโดยไม่มีผลข้างเคียงร้ายแรง ในกรณีรุนแรง เนื่องจากไตวายเฉียบพลัน การพยากรณ์โรคอาจไม่ดีนัก ในช่วงไม่กี่ปีที่ผ่านมา ได้มีการพิจารณาถึงลักษณะภูมิคุ้มกันของร่างกายที่ทำให้เกิดเม็ดเลือดแดงแตกเฉียบพลัน ซึ่งเกี่ยวข้องกับการใช้ยาป้องกันมาเลเรียเป็นเวลานานและบ่อยครั้ง เช่น ควินินและพรีมาควิน พบว่ามีไข้สูง (มีปรสิตในเลือดเล็กน้อย) ปัสสาวะเป็นสีดำ โลหิตจาง เม็ดเลือดขาวสูง เม็ดเลือดแดงแตกเร็วขึ้น ผลการตรวจเลือดระบุว่าไตวายจะลุกลามอย่างรวดเร็ว ซึ่งนำไปสู่ผลลัพธ์ที่ร้ายแรงหากไม่ได้รับการบำบัดที่เหมาะสม
มาลาเรียชนิด Algid มีลักษณะทางคลินิกที่คล้ายกับอาการช็อกจากพิษติดเชื้อ ได้แก่ ความผิดปกติของการไหลเวียนโลหิตและการไหลเวียนโลหิตระดับจุลภาค ความผิดปกติของระบบการหยุดเลือด อวัยวะหลายส่วนล้มเหลว และอุณหภูมิร่างกายต่ำกว่าปกติ ซึ่งแตกต่างจากมาลาเรียในสมอง ผู้ป่วยจะรู้สึกตัวได้แม้ว่าจะอาจมีอาการโคม่าในภายหลังก็ตาม มาลาเรียชนิด Algid อาจพัฒนาขึ้นโดยมีอาการบวมน้ำในปอด กรดเกินในเลือด และภาวะขาดน้ำอย่างรุนแรง สังเกตได้ว่ามีปรสิตในกระแสเลือดสูง การพยากรณ์โรคส่วนใหญ่ขึ้นอยู่กับการรักษาที่ถูกต้องและทันท่วงที
อาการบวมน้ำในปอดเฉียบพลันในผู้ป่วยมาเลเรียเขตร้อนมักนำไปสู่การเสียชีวิต กลไกของภาวะแทรกซ้อนร้ายแรงนี้ยังไม่ผ่านการศึกษาอย่างเต็มที่ อาการบวมน้ำในปอดอาจเกิดจากการดื่มน้ำมากเกินไป แต่สามารถเกิดขึ้นได้เมื่อมีแรงดันปกติในระบบไหลเวียนของปอด ปัจจุบัน นักวิจัยส่วนใหญ่ถือว่าภาวะระบบทางเดินหายใจล้มเหลวเฉียบพลันในมาเลเรียเขตร้อนเป็นสัญญาณบ่งชี้ของกลุ่มอาการหายใจลำบากในผู้ใหญ่
ภาวะแทรกซ้อนทางคลินิกที่หายากแต่ร้ายแรงของมาเลเรียในรูปแบบใดๆ ที่มีหรือไม่มีม้ามโตเกินปกติคือม้ามแตก การแตกอาจเกิดจากการบิดของก้านม้ามพร้อมกับเลือดคั่งเฉียบพลันและการเกิดเลือดคั่งใต้แคปซูล
ในโรคมาลาเรียเขตร้อน อาจเกิดรอยโรคที่กระจกตา ม่านตาอักเสบ ไอริโดไซไลติส วุ้นตาขุ่นมัว เส้นประสาทตาอักเสบ โคริโอเรติไนติส และเลือดออกที่จอประสาทตาได้ มีรายงานอาการอัมพาตของกล้ามเนื้อตาที่เกิดจากรอยโรคของเส้นประสาทสมองคู่ที่ 3, 4 และ 6 และอาการอัมพาตของการปรับโฟกัส
โรคมาลาเรียกำเริบอีกครั้ง
ระดับของปรสิตในเลือดระหว่างการกำเริบมักจะต่ำกว่าในช่วงที่มีอาการหลักของมาเลเรีย เนื่องจากเกณฑ์การทำให้เกิดไข้เพิ่มขึ้นในระหว่างการติดเชื้อ อาการทางคลินิกในระหว่างการกำเริบมักจะเกิดขึ้นพร้อมกับปรสิตในเลือดที่สูงขึ้น การกำเริบมักจะดำเนินต่อไปอย่างไม่เป็นอันตราย โดยมีอาการพิษในระดับปานกลางและอาการกำเริบของมาเลเรียสลับกันอย่างสม่ำเสมอตั้งแต่เริ่มกำเริบ จำนวนการกำเริบจะน้อยกว่าอย่างมีนัยสำคัญเมื่อเทียบกับในช่วงที่มีอาการหลักของโรค ตามระยะเวลาที่เริ่มมีอาการ การกำเริบในระยะเริ่มต้น (การพัฒนาของอาการทางคลินิกในช่วง 2 เดือนแรกหลังจากอาการหลักของมาเลเรีย) และระยะหลัง (หลังจาก 2 เดือน) จะแตกต่างกัน ตามแหล่งกำเนิด การกำเริบจะแบ่งออกเป็นแบบเอริโทรไซต์ (มาเลเรียทุกรูปแบบ) และแบบเอริโทรไซต์ภายนอก (เฉพาะในมาเลเรีย-ไวแวกซ์และโอวาเล)
การวินิจฉัย มาลาเรีย
การวินิจฉัยโรคมาเลเรียอาศัยข้อมูลทางระบาดวิทยา (การอยู่บริเวณที่มีโรคมาเลเรียสูง การขาดหรือการใช้ยาป้องกันไม่เพียงพอ) ภาพทางคลินิกของโรค (การโจมตีที่เป็นลักษณะเฉพาะ) และยืนยันด้วยการทดสอบในห้องปฏิบัติการ
การวินิจฉัยโรคมาเลเรียควรคำนึงถึง:
- โรคเริ่มเฉียบพลัน อาการพิษที่รุนแรง การดำเนินโรคเป็นรอบโดยมีไข้สลับกับอาการไม่มีไข้เป็นระยะ ตับและม้ามโต และเริ่มเป็นโรคโลหิตจางจากเม็ดเลือดแดงแตกอย่างก้าวหน้า
- ข้อมูลประวัติระบาดวิทยา (อยู่ในพื้นที่เสี่ยงสูงต่อโรคมาเลเรีย การถ่ายเลือด การติดยาเสพติด)
ระยะเวลาของการเกิดมาเลเรีย โดยคำนึงถึงการเกิดการกำเริบจากการติดเชื้อเพียงครั้งเดียว และไม่ได้รับการบำบัดสาเหตุที่เหมาะสม
รูปแบบของโรคมาลาเรีย |
ระยะเวลาของการติดเชื้อ |
|
ปกติ |
สูงสุด |
|
มาลาเรีย-ฟัลซิปารัม |
นานถึง 1 ปี |
สูงถึง 3 ปี |
มาลาเรีย-มาลาเรีย |
นานถึง 2-3 ปี |
เป็นไปได้สำหรับชีวิต |
มาลาเรีย-ไวแวกซ์และโอวาเล่ |
นานถึง 1.5-2 ปี |
สูงสุด 4-5 ปี |
- ผลการทดสอบในห้องปฏิบัติการ:
- ผลการตรวจฮีโมแกรม: ระดับฮีโมโกลบินลดลง เม็ดเลือดขาวต่ำ ลิมโฟโมโนไซต์สูงขึ้น ESR เพิ่มขึ้น
- ผลการตรวจเลือดหยดหนาด้วยกล้องจุลทรรศน์ (มองเห็นได้อย่างน้อย 100 ช่อง ในกรณีที่มีปรสิตในเลือดต่ำ): ตรวจหาพลาสโมเดียและกำหนดระดับของปรสิตในเลือด 1 µl (เลือด 0.2 µl มีมุมมอง 100 ช่อง)
สิ่งนี้จำเป็น:
- เพื่อเลือกระดับความเข้มข้นของการบำบัดโรคมาลาเรียโดยเฉพาะ (โดยมีระดับปรสิตในเลือดสูงในผู้ป่วยมาลาเรียเขตร้อน การให้ยาทางเส้นเลือดจึงเป็นทางเลือกที่ดีกว่า)
- เพื่อติดตามประสิทธิผลของการบำบัดเฉพาะทาง
ระดับของการติดเชื้อปรสิตในเลือดสามารถประเมินได้โดยการนับเปอร์เซ็นต์ของเม็ดเลือดแดงที่ได้รับผลกระทบต่อเม็ดเลือดขาว 100 เซลล์ในเลือดหยดหนา (ในกรณีนี้ หากต้องการประเมินจำนวนปรสิตใน 1 μl จำเป็นต้องทราบจำนวนเม็ดเลือดขาวและเม็ดเลือดแดงทั้งหมดใน 1 μl ในผู้ป่วย)
- ข้อมูลกล้องจุลทรรศน์ของเลือดที่เปื้อนเพื่อระบุชนิดของพลาสโมเดียม หยดเลือดที่หนาและเลือดที่เปื้อนจะถูกย้อมโดยใช้เทคนิค Romanovsky-Giemsa
เนื่องมาจากการสะสมของเม็ดเลือดแดงที่บุกรุกซึ่งมีโทรโฟโซอิตและสคิซอนต์ที่โตเต็มวัยในหลอดเลือดของอวัยวะภายใน เมื่อตรวจสอบการเตรียมหยดหนาในมาลาเรียฟัลซิปารัมชนิดไม่รุนแรง จะระบุได้เฉพาะโทรโฟโซอิตที่อายุน้อย (ระยะแหวน) ในเม็ดเลือดแดงเท่านั้น การปรากฏของเม็ดเลือดแดงที่บุกรุกซึ่งมีระยะการพัฒนาของปรสิตในผู้ใหญ่ (โทรโฟโซอิตที่โตเต็มวัยหรืออะมีบอยด์ สคิซอนต์) ในเลือดส่วนปลายเป็นสัญญาณห้องปฏิบัติการที่ไม่พึงประสงค์ซึ่งบ่งชี้ถึงการดำเนินโรคของมาลาเรียฟัลซิปารัมที่รุนแรง (ซับซ้อน)
ระดับของปรสิตในเลือดในมาเลเรีย
ระดับของปรสิตในเลือด |
การกำหนดแบบธรรมดา |
จำนวนปรสิตในลานสายตา |
จำนวนปรสิตในเลือด 1 µl |
สี่ |
- |
1-20 ใน 100 สนาม |
5-50 |
ที่สาม |
- |
10-100 ใน 100 สนาม |
50-500 |
ครั้งที่สอง |
- |
1-10 ใน 1 สนาม |
500-5000 |
ฉัน |
- |
มากกว่า 10 ใน 1 สนาม |
มากกว่า 5,000 |
ในบุคคลที่สัมผัสเชื้อนี้เป็นครั้งแรก (ไม่มีภูมิคุ้มกัน) ซึ่งเป็นเด็กเล็ก การโจมตีครั้งแรกอาจเกิดขึ้นโดยมีปริมาณปรสิตในเลือดต่ำมาก ซึ่งบางครั้งตรวจไม่พบด้วยกล้องจุลทรรศน์ ซึ่งต้องตรวจเลือดซ้ำ (หยดเลือดหนา) หลังจาก 6-12 ชั่วโมง แต่ไม่เกิน 24 ชั่วโมง
การวินิจฉัยโรคมาเลเรียในห้องปฏิบัติการเกี่ยวข้องกับการตรวจตัวอย่างเลือดด้วยกล้องจุลทรรศน์ (วิธีหยดเลือดหนาและวิธีหยดเลือดบาง) ที่ย้อมตามวิธี Romanovsky-Giemsa
ผู้ป่วยต่อไปนี้ต้องเข้ารับการตรวจมาลาเรีย: ผู้ป่วยที่มีไข้และไม่ทราบสาเหตุเป็นเวลา 3 วันในช่วงที่มีการระบาด และ 5 วันในช่วงที่เหลือของปี ผู้ป่วยที่มีอุณหภูมิร่างกายสูงขึ้นเป็นระยะๆ แม้จะได้รับการรักษาตามการวินิจฉัยที่กำหนดไว้แล้ว ผู้รับเลือดที่มีอุณหภูมิร่างกายสูงขึ้นในช่วง 3 เดือนหลังการถ่ายเลือด บุคคลที่อาศัยอยู่ในศูนย์รวมผู้ป่วยที่มักมีอุณหภูมิร่างกายสูงขึ้น ควรคำนึงว่าในระหว่างการโจมตีของมาลาเรียครั้งแรก จำนวนปรสิตในเลือดส่วนปลายจะมีน้อย ดังนั้นจึงจำเป็นต้องตรวจอย่างละเอียดที่สุด มาลาเรียที่มีปรสิตในเลือดต่ำมักพบในผู้ที่ใช้ยาป้องกันมาลาเรียเพื่อวัตถุประสงค์ในการป้องกัน (การบำบัดกดภูมิคุ้มกัน) หรือยา (เตตราไซคลิน ซัลโฟนาไมด์) ที่มีผลกดภูมิคุ้มกันพลาสโมเดียของมาลาเรียก่อนเกิดโรค แนะนำให้เก็บตัวอย่างเลือดเพื่อตรวจทั้งในขณะที่มีไข้และอาการไม่มีไข้ การตรวจหาปรสิตนั้นต้องตรวจด้วยหยดเลือดที่หนา เนื่องจากปริมาณเลือดในหยดเลือดนั้นมากกว่าเลือดที่หยดในสเมียร์บางๆ ถึง 30-40 เท่า ในกรณีที่มีปรสิตในเลือดสูง จะตรวจพบเชื้อก่อโรคมาเลเรียได้แม้จะตรวจสเมียร์ที่บางก็ตาม ลักษณะทางสัณฐานวิทยาและคุณสมบัติการย้อมสี (การย้อมสี) ของระยะอายุต่างๆ ของรูปแบบไม่อาศัยเพศในเม็ดเลือดแดงนั้นสามารถแยกแยะได้อย่างชัดเจนในสเมียร์ที่บาง จำเป็นต้องกำหนดประเภทของปรสิต ซึ่งเป็นสิ่งสำคัญโดยเฉพาะอย่างยิ่งสำหรับ P. falciparum ในมาลาเรียเขตร้อนที่ไม่มีภาวะแทรกซ้อน P. falciparum จะตรวจพบในเลือดส่วนปลายเฉพาะในระยะของโทรโฟโซอิตรูปวงแหวนที่ยังอายุน้อยเท่านั้น ในกรณีของการติดเชื้อขั้นต้น จะตรวจพบปรสิตในระยะที่โตเต็มที่ในเลือดส่วนปลายเมื่อโรคดำเนินไปอย่างรุนแรง ภาวะปรสิตในเลือดส่วนปลายจะเพิ่มขึ้นเร็วกว่าการติดเชื้อจากเชื้อก่อโรคชนิดอื่น เซลล์สืบพันธุ์ของ P. falciparum จะเจริญเติบโตช้า แต่มีชีวิตอยู่ได้นาน (นานถึง 6 สัปดาห์) ในขณะที่เซลล์สืบพันธุ์ของสปีชีส์อื่นจะตายไปหลายชั่วโมงหลังจากเจริญเติบโต เซลล์สืบพันธุ์ที่ตรวจพบในมาเลเรียเขตร้อนจะช่วยกำหนดระยะเวลาของโรคได้ ในระยะแรก (โดยมีอาการไม่ซับซ้อน) จะตรวจพบเฉพาะโทรโฟโซอิตรูปวงแหวน ในช่วงพีคจะตรวจพบเฉพาะวงแหวนและเซลล์สืบพันธุ์ (โดยมีการติดเชื้อขั้นต้นในกรณีที่ไม่มีการรักษา ซึ่งบ่งชี้ว่ามาเลเรียจะคงอยู่เป็นเวลาอย่างน้อย 10-12 วัน) ในช่วงฟื้นตัว จะพบเฉพาะเซลล์สืบพันธุ์เท่านั้น ในระหว่างการรักษา ระดับของปรสิตในเลือดส่วนปลายจะถูกกำหนดตามพลวัต หนึ่งวันหลังจากเริ่มการรักษาแบบเอทิโอโทรปิก ควรลดลง 25% หรือมากกว่า และในวันที่ 3 ไม่ควรเกิน 25% ของระดับเริ่มต้น การมีปรสิตในเลือดที่เตรียมในวันที่ 4 หลังจากเริ่มการรักษา โดยขึ้นอยู่กับเงื่อนไขทั้งหมดสำหรับการรักษาที่ประสบความสำเร็จ เป็นสัญญาณบ่งชี้ว่าเชื้อก่อโรคดื้อยาที่ใช้
ในช่วงไม่กี่ปีที่ผ่านมา การทดสอบอย่างรวดเร็ว (วิธีอิมมูโนโครมาโตกราฟี) ที่ใช้การตรวจจับโปรตีนจำเพาะ HRP-2a และเอนไซม์ pLDH ของ P. falciparum ถูกนำมาใช้ในจุดที่เกิดโรคประจำถิ่นเพื่อให้ได้คำตอบเบื้องต้นอย่างรวดเร็ว การทดสอบการทดสอบอย่างรวดเร็วที่รู้จักกันดีอย่างหนึ่งคือ KAT-PF (KAT MEDICAL, South Africa) แสดงให้เห็นถึงประสิทธิภาพและความจำเพาะสูงเมื่อเทียบกับ P. falciparum การเปรียบเทียบผลลัพธ์ของการทดสอบอย่างรวดเร็ว กล้องจุลทรรศน์ และ PCR แสดงให้เห็นว่าประสิทธิภาพในการวินิจฉัยสูงถึง 95-98% การใช้การทดสอบอย่างรวดเร็วช่วยให้คุณทราบผลภายในเวลาเพียง 10 นาที บุคลากรในห้องปฏิบัติการสามารถเรียนรู้ปฏิกิริยาได้ภายใน 1-2 ชั่วโมง วิธีการอย่างรวดเร็วทำให้ผู้คนที่อาศัยหรือเดินทางไปในพื้นที่ที่เกิดโรคประจำถิ่นสามารถวินิจฉัยโรคได้ด้วยตนเอง ซึ่งสามารถทำได้ในภาคสนาม ในรัสเซีย การวินิจฉัยโรคมาลาเรียอย่างรวดเร็วในปัจจุบันจำกัดอยู่แค่การศึกษาทางคลินิกแบบรายบุคคลเท่านั้น
ในสภาวะปัจจุบัน โดยเฉพาะในการศึกษาวิจัยแบบกลุ่ม วิธี PCR ที่อาศัยการตรวจหา DNA ของปรสิตมาเลเรียมีความสำคัญเป็นพิเศษ วิธีดังกล่าวสามารถใช้ตรวจหาพาหะของปรสิตในเลือดต่ำและการติดเชื้อแบบผสมที่มีพลาสโมเดียชนิดต่างๆ ได้ รวมถึงแยกความแตกต่างระหว่างการกลับมาเป็นซ้ำของมาเลเรียที่ดื้อยาจากการติดเชื้อซ้ำด้วยเชื้อ P. falciparum ปัจจุบัน วิธีดังกล่าวใช้เป็นหลักในการศึกษาทางระบาดวิทยา
ต้องการทดสอบอะไรบ้าง?
การวินิจฉัยที่แตกต่างกัน
การตรวจวินิจฉัยแยกโรคมาเลเรียจะดำเนินการโดยพิจารณาจากความรุนแรงของอาการทางคลินิกของโรคและระยะเวลาของโรค ประการแรก โรคมาเลเรียจะแตกต่างจากโรคที่มักมีไข้เป็นเวลานาน ตับโต ม้ามโต และอาจมีภาวะโลหิตจาง เช่น ไข้ไทฟอยด์ ไข้พาราไทฟอยด์ โรคบรูเซลโลซิส โรคเลปโตสไปโรซิส การติดเชื้อในกระแสเลือด และโรคต่อมน้ำเหลืองโต ในช่วง 5 วันแรกหลังจากเริ่มมีโรค การวินิจฉัยโรคมาเลเรียในภูมิภาคที่ไม่ระบาดโดยผิดพลาดคือ ไข้หวัดใหญ่ (หรือการติดเชื้อไวรัสทางเดินหายใจเฉียบพลันชนิดอื่น)
ในประเทศเขตร้อนของอเมริกาใต้ แอฟริกา เอเชียตะวันออกเฉียงใต้ และอินเดีย จะทำการวินิจฉัยแยกโรคมาลาเรียกับไข้ไวรัสที่มีเลือดออก (ไข้เหลือง ไข้เลือดออก เป็นต้น)
ในกรณีของมาเลเรียฟัลซิปารัมในสมอง การวินิจฉัยแยกโรคมาเลเรียจะดำเนินการโดยมีอาการสมองเสื่อม (โคม่า) ซึ่งพัฒนามาพร้อมกับโรคเบาหวานชนิดที่ 2 ตับและไตวาย รวมถึงอาการบวมน้ำและบวมของสมองร่วมกับอาการเยื่อหุ้มสมองอักเสบหรือเยื่อหุ้มสมองอักเสบจากเชื้อแบคทีเรียหรือไวรัส
ใครจะติดต่อได้บ้าง?
การรักษา มาลาเรีย
การรักษาโรคมาลาเรียได้แก่ การหยุดยั้งการโจมตีเฉียบพลันของโรค ป้องกันการกำเริบและการขนส่งเซลล์สืบพันธุ์ และฟื้นฟูการทำงานของร่างกายที่บกพร่อง
ยาต้านมาเลเรียแบ่งออกเป็นกลุ่มต่างๆ ดังต่อไปนี้ โดยพิจารณาจากผลต่อระยะใดระยะหนึ่งในการพัฒนาปรสิต: ยาสร้างเม็ดเลือดและไคโซโทรปิก ซึ่งมีประสิทธิภาพต่อระยะเม็ดเลือดแดงที่ไม่อาศัยเพศของพลาสโมเดีย; ยาฮิสโตไคโซโทรปิก ซึ่งมีประสิทธิภาพต่อระยะเนื้อเยื่อที่ไม่อาศัยเพศของพลาสโมเดีย; ยาแกมโมโทรปิก ซึ่งทำให้แกมีโตไซต์ในเลือดของผู้ป่วยตาย หรือขัดขวางการเจริญเติบโตของแกมีมอนท์และการสร้างสปอโรซอยต์ในร่างกายของยุง
การรักษาต้นตอโรค
ควรกำหนดการรักษาโรคมาลาเรียตามสาเหตุในผู้ป่วยโรคมาลาเรียทันทีหลังจากการวินิจฉัยทางคลินิกและทางระบาดวิทยาและการเก็บเลือดเพื่อการตรวจปรสิต
ยาที่ใช้ในปัจจุบันอยู่ในกลุ่มสารเคมี 6 กลุ่ม ได้แก่ 4-aminoquinolines (chloroquine - delagyl, chloroquine phosphate, nivaquine), quinolinemethanols (quinine - quinine dihydrochloride, quinine sulfate, quinimax, mefloquine), phenanthrenemethanols (halfan, halofantrine), artemisinin deriveds (artesunate, artemether, arteether), antimetabolites (proguanil), 8-aminoquinolines (primaquine, tafenoquine) นอกจากนี้ยังมีการใช้ยาต้านมาเลเรียแบบผสม ได้แก่ savarin (chloroquine + proguanil), malarone (atovaquone + proguanil), coartem หรือ riamet (artemether + lumefantrine)
หากตรวจพบเชื้อ P. vivax, P. ovale หรือ P. malariae ในผู้ป่วย จะใช้ยาจากกลุ่ม 4-aminoquinoline ซึ่งส่วนใหญ่มักเป็นคลอโรควิน (delagyl) การรักษามาลาเรียทำได้ดังนี้ สองวันแรก ให้ใช้ยาในขนาด 10 มก./กก. ของเบส (เม็ดเดลาจิล 4 เม็ดต่อครั้ง) วันที่ 3 ให้ยา 5 มก./กก. (เม็ดเดลาจิล 2 เม็ด) ครั้งเดียว มีรายงานแยกกันของเชื้อ P. vivax ที่ดื้อต่อคลอโรควินในพม่า อินโดนีเซีย ปาปัวนิวกินี และวานูอาตู ในกรณีดังกล่าว ควรใช้เมฟโลควินหรือควินินตามแผนการรักษาสำหรับมาลาเรียที่ไม่มีภาวะแทรกซ้อน อาการกำเริบจะหยุดลงหลังจาก 24-48 ชั่วโมง และปรสิตจะหายไปจากเลือด 48-72 ชั่วโมงหลังจากเริ่มรับประทานคลอโรควิน
ในการรักษามาลาเรียที่เกิดจากเชื้อ P. vivax หรือ P. ovale ให้หายขาด (ป้องกันการกำเริบซ้ำระยะไกล) หลังจากสิ้นสุดระยะการรักษาด้วยคลอโรควินแล้ว ให้ใช้ไพรมาควินซึ่งเป็นยาฆ่าแมลงในเนื้อเยื่อ โดยรับประทานเป็นเวลา 14 วันด้วยขนาดยา 0.25 มก./กก. (เบส) ต่อวัน พบเชื้อ P. vivax ที่ดื้อต่อไพรมาควิน (ซึ่งเรียกว่าสายพันธุ์เชสสัน) บนเกาะในมหาสมุทรแปซิฟิกและประเทศในเอเชียตะวันออกเฉียงใต้ ในกรณีดังกล่าว แนะนำให้ใช้ไพรมาควินในขนาดยา 0.25 มก./กก. ต่อวันเป็นเวลา 21 วัน
หากตรวจพบเชื้อ P. falciparum ในเลือดของผู้ที่ไม่ได้รับภูมิคุ้มกันในกรณีที่ไม่รุนแรง ยาที่เลือกใช้ตามคำแนะนำของ WHO คือ mefloquine และอนุพันธ์ของ artemisinin (artemether, artesunate, arteether) สามารถใช้ฮาโลแฟนทรินได้เช่นกัน ในกรณีที่ไม่มี mefloquine และ halofantrine และ/หรือมีข้อห้ามในการใช้ยาเหล่านี้ แพทย์จะสั่งจ่ายควินินร่วมกับยาปฏิชีวนะ (tetracycline, doxycycline) โดยให้รับประทานเตตราไซคลิน 0.5 กรัม วันละ 2 ครั้ง เป็นเวลา 7-10 วัน โดยสามารถทดแทนด้วย doxycycline ในขนาด 0.1 กรัมต่อวัน โดยให้ยาเป็นเวลา 7-10 วัน ในภูมิภาคที่เชื้อ P. falciparum ดื้อต่อ mefloquine และ quinine แนะนำให้ใช้ mefloquine และ artemisinin (artesnate, artemether) ร่วมกันในการรักษามาลาเรียเขตร้อนที่ไม่มีภาวะแทรกซ้อน การผสมฟานซิดาร์และอาร์เทซูเนตมีประสิทธิภาพในการรักษามาเลเรียเขตร้อนที่ไม่มีภาวะแทรกซ้อน อาร์เทมิซินินเป็นยาที่ใช้กันอย่างแพร่หลายในการรักษามาเลเรียเขตร้อนที่ดื้อยาหลายตัวในเอเชียตะวันออกเฉียงใต้ หลายประเทศในอเมริกาใต้ และแอฟริกา ยาออกฤทธิ์เร็วมากทั้งในระยะของเลือดและเซลล์สืบพันธุ์ อย่างไรก็ตาม ยาเหล่านี้จะถูกขับออกจากร่างกายอย่างรวดเร็ว ซึ่งเป็นสาเหตุที่มาเลเรียกลับมาเป็นซ้ำได้ จึงเหมาะสมกว่าที่จะกำหนดให้ใช้ร่วมกับเมฟโลควินในขนาดยาต่อไปนี้:
- อาร์เทซูเนต: 4 มก./กก. วันละ 2 ครั้งเป็นเวลา 3 วัน; เมฟโลควิน: 15 มก./กก. ครั้งเดียวในวันที่ 2 หรือ 25 มก./กก. ใน 2 ครั้งในวันที่ 2 และ 3;
- อาร์เทมิเธอร์: 3.2 มก./กก. ครั้งเดียวต่อวันเป็นเวลา 3 วัน; เมฟโลควิน: 15 มก./กก. ครั้งเดียวในวันที่ 2 หรือ 25 มก./กก. ใน 2 ครั้งในวันที่ 2 และ 3
แนวทางการรักษาโรคมาเลเรียแบบไม่มีภาวะแทรกซ้อน
แผนการสมัคร |
|||
การตระเตรียม |
โดสแรก มก./กก. |
ขนาดยาถัดไป มก./กก. (ช่วงเวลา ชม.) |
ระยะเวลาหลักสูตร วัน |
คลอโรควิน |
10 (พื้นดิน) |
10- 1-2 วัน 5 - 3 วัน |
3 |
แฟนซิดาร์ (ซัลฟาดอกซีน + ไพริเมทามีน) |
2.50-1.25 |
- |
1 |
ควินิน คินิแมกซ์ คิโนฟอร์ม |
10 (พื้นดิน) |
7.5 (8) |
7-10 |
เมฟโลควิน |
15 (พื้นดิน) |
- |
1 |
ฮาโลแฟนทริน |
8 (เกลือ) |
8 (6) |
1 |
อาร์เทซูเนต |
4 |
2 (12) |
7 |
อาร์เทเมเธอร์ |
3.2 |
1.6 (24) |
7.0 |
ควินิน-เตตราไซคลิน |
10.0-1.5 |
10.0 (8)+5.0 (6) |
10.0+7.0 |
โคอาร์เท็ม (อาร์เทเมเธอร์ + ลูเมแฟนทริน) |
1.3+8 0 |
1.3-8.0 (8) |
3.0 |
หากไม่ทราบชนิดของเชื้อก่อโรค แนะนำให้รักษาตามแนวทางการรักษามาเลเรียเขตร้อน หากผู้ป่วยอาเจียนเร็วกว่า 30 นาทีหลังจากรับประทานยาป้องกันมาเลเรียที่แพทย์สั่ง ควรรับประทานยาในขนาดเดิมอีกครั้ง หากอาเจียนหลังจากรับประทานยา 30-60 นาที ควรสั่งยาเพิ่มครึ่งหนึ่งของขนาดยา
ผู้ป่วยที่เป็นมาเลเรียเขตร้อนรุนแรงควรเข้ารับการรักษาในโรงพยาบาลในห้องไอซียูหรือแผนกช่วยชีวิต ควินินยังคงเป็นยาที่เลือกใช้ในการรักษามาเลเรียเขตร้อนรุนแรง เมื่อรักษามาลาเรียชนิดซับซ้อน (มาลาเรียในสมอง มาลาเรียชนิดอัลจิเนต) จะให้ยาควินินเบสขนาดแรก (7 มก./กก.) ทางเส้นเลือดดำเป็นเวลา 30 นาที จากนั้นให้ยาอีก 10 มก./กก. ทางเส้นเลือดดำโดยหยดเป็นเวลา 4 ชั่วโมง ดังนั้น ผู้ป่วยจะได้รับควินินเบส 17 มก./กก. ภายใน 4.5 ชั่วโมงแรกหลังจากเริ่มการรักษา ตามแผนการรักษาอื่น จะให้ยาควินินเบสขนาดเริ่มต้น 20 มก./กก. เป็นเวลา 4 ชั่วโมง ผู้ป่วยสามารถทนต่อยาทั้งสองแผนการรักษาได้อย่างน่าพอใจ โดยไม่มีโรคหลอดเลือดหัวใจหรือความผิดปกติอื่นๆ ให้ยาควินินเบสขนาด 10 มก./กก. ทุกๆ 8 ชั่วโมง โดยให้ยาเป็นเวลา 1.5-2 ชั่วโมง แนะนำให้ใช้ควินินร่วมกับเตตราไซคลิน (250 มก. วันละ 4 ครั้ง เป็นเวลา 7 วัน) หรือดอกซีไซคลิน (0.1 กรัมต่อวัน เป็นเวลา 7-10 วัน) สำหรับการรักษาเด็ก แนะนำให้ฉีดควินินเบสขนาดเริ่มต้น (15 มก./กก.) เข้าเส้นเลือดดำโดยหยดสารละลายกลูโคส 5% เป็นเวลา 4 ชั่วโมง ขนาดยาบำรุงรักษา (10 มก./กก.) เป็นเวลา 2 ชั่วโมง โดยเว้นระยะห่าง 12 ชั่วโมง ขนาดยาเท่ากันนี้ใช้สำหรับฉีดเข้ากล้ามเนื้อ แต่แนะนำให้เจือจางควินิน 5 เท่าในน้ำกลั่น และแบ่งเป็น 2 ครั้งในการฉีดที่ก้นคนละข้าง
อาร์เทเมเธอร์ใช้เป็นยาทางเลือกในการรักษามาลาเรียเขตร้อนชนิดซับซ้อน โดยให้ยาขนาด 3.2 มก./กก. ต่อวันในวันแรกของการรักษา ใน 6 วันถัดมา ให้ยาขนาด 1.6 มก./กก. ฉีดเข้ากล้ามเนื้อร่วมกับเมฟโลควิน 1 ครั้ง
ผู้ป่วยที่เป็นมาเลเรียชนิดรุนแรงและซับซ้อนจะต้องได้รับการบำบัดทางพยาธิวิทยาอย่างเข้มข้น เมื่อให้สารน้ำ ควรระวังอาการบวมน้ำในปอดและสมอง แต่ภาวะเลือดน้อยก็เป็นอันตรายไม่แพ้กัน หากให้สารน้ำไม่ได้ผล ผู้ป่วยอาจเกิดภาวะเลือดไปเลี้ยงเนื้อเยื่อไม่เพียงพอ กรดเกิน ความดันโลหิตต่ำ ช็อก และไตวาย ภาวะโลหิตจางมักไม่เป็นอันตรายถึงชีวิต แต่หากระดับฮีมาโตคริตลดลงเหลือ 15-20% ควรให้เม็ดเลือดแดงหรือเลือดทั้งหมด การให้เลือดทั้งหมดสดหรือสารเข้มข้นของปัจจัยการแข็งตัวของเลือดและเกล็ดเลือดจะใช้ในโรค DIC ในกรณีที่มีภาวะน้ำตาลในเลือดต่ำ ควรให้สารละลายกลูโคส 40% ทางเส้นเลือด
พื้นฐานของการรักษาอาการบวมน้ำในสมองคือการล้างพิษ การขาดน้ำ การควบคุมภาวะขาดออกซิเจนในสมองและความผิดปกติของระบบทางเดินหายใจ (การบำบัดด้วยออกซิเจน การช่วยหายใจด้วยเครื่องช่วยหายใจ) การให้ยากันชักจะดำเนินการตามที่ระบุ ประสบการณ์ในการรักษามาลาเรียในสมองได้พิสูจน์แล้วว่าการใช้ยาขับปัสสาวะแบบออสโมติก ได้แก่ เดกซ์ทรานส์ที่มีน้ำหนักโมเลกุลต่ำ อะดรีนาลีน พรอสตาไซคลิน เพนทอกซิฟิลลิน ไซโคลสปอริน ซีรั่มไฮเปอร์อิมมูนนั้นไม่มีประสิทธิภาพและอาจเป็นอันตรายได้ นอกจากนี้ ยังไม่แนะนำให้ใช้ออกซิเจนแรงดันสูง
ในกรณีของไตวายเฉียบพลันหรือไตวายเฉียบพลันและตับวาย ควรลดขนาดยาควินินรายวันลงเหลือ 10 มก./กก. เนื่องจากยาอาจสะสมได้ และควรให้สารละลายในอัตรา 20 หยดต่อนาที ในช่วงเริ่มต้นของไตวายเฉียบพลัน จะต้องขับปัสสาวะออก และหากไม่มีผลและเลือดไหลมากขึ้น จะต้องฟอกไตหรือล้างไตทางช่องท้อง ซึ่งมักจะให้ผลดี ในกรณีของไข้ฮีโมโกลบินยูริก ควรหยุดใช้ยาที่ทำให้เกิดการแตกของเม็ดเลือดแดง หากจำเป็น ให้เปลี่ยนเป็นยาต้านมาเลเรียชนิดอื่น และกำหนดให้ใช้กลูโคคอร์ติโคสเตียรอยด์ (เพรดนิโซโลน 1-2 มก./กก.) และการบำบัดด้วยการล้างพิษในเวลาเดียวกัน
ในกรณีของม้ามแตกซึ่งมักเกิดขึ้นในกรณีที่อวัยวะขยายตัวอย่างรวดเร็วและมาก อาจมีการระบุให้ใช้การผ่าตัดฉุกเฉิน
ในการรักษาการกลับมาเป็นซ้ำของมาเลเรียเขตร้อน ให้เลือกใช้ยาที่ไม่เคยใช้มาก่อน หรือใช้ยาตัวเดิมร่วมกับยาต้านมาเลเรียตัวอื่น ขับเซลล์สืบพันธุ์ออกด้วยไพรมาควินเป็นเวลา 1-3 วันในขนาดยาปกติ
ประสิทธิภาพของการรักษาโรคมาลาเรียจะถูกตรวจสอบโดยการตรวจเลือดหยดหนาพร้อมจำนวนปรสิตในเลือด 1 μl การศึกษานี้จะดำเนินการทุกวันตั้งแต่วันที่ 1 ถึงวันที่ 7 หลังจากเริ่มการรักษาตามสาเหตุ หากปรสิตหายไปในช่วงเวลานี้ การศึกษาเพิ่มเติมเกี่ยวกับการเตรียมเลือดจะดำเนินการในวันที่ 14, 21 และ 28 หลังจากเริ่มการรักษา
การประเมินผลประสิทธิผล
ประสิทธิผลของการรักษาโรคมาลาเรียในผู้ป่วยโรคมาลาเรียประเมินจากสามพารามิเตอร์ ได้แก่ ความล้มเหลวระยะเริ่มต้น (EF) ความล้มเหลวระยะท้าย (LF) และการรักษาที่มีประสิทธิผล
หลังจากรับประทานยาป้องกันมาเลเรีย ผู้ป่วยอาจอาเจียนได้ (โดยเฉพาะในเด็ก) สิ่งสำคัญที่ต้องจำไว้คือ หากเกิดอาการอาเจียนภายใน 30 นาทีหลังจากรับประทานยา ควรรับประทานยาขนาดเดิมอีกครั้ง และหลังจากผ่านไป 30-60 นาที ให้รับประทานยาขนาดครึ่งหนึ่งของขนาดยาที่ใช้
การประเมินประสิทธิผลของการรักษาโรคมาลาเรีย (WHO, 1996)
ความล้มเหลวในระยะเริ่มต้น (EF) |
อาการทางคลินิกของมาเลเรียที่แย่ลงหรือยังคงมีอยู่อย่างต่อเนื่องในขณะที่มีปรสิตในเลือดในช่วง 3 วันแรกนับจากเริ่มการบำบัดเฉพาะ |
ความล้มเหลวในภายหลัง (LF) |
การกลับมาของอาการทางคลินิกที่เป็นลักษณะเฉพาะของมาเลเรีย (รวมถึงการพัฒนาของภาวะที่รุนแรง) เมื่อมีปรสิตในเลือดตั้งแต่วันที่ 4 ถึงวันที่ 14 นับจากเริ่มการบำบัดเฉพาะ |
ประสิทธิผลของการรักษา |
การขาดปรสิตในเลือดหลังจาก 14 วันนับจากเริ่มการบำบัดเฉพาะโดยไม่มีเกณฑ์ RN และ PN |
การรักษาโรคมาเลเรียแบบรุนแรง
การรักษาโรคมาเลเรียแบบรุนแรงจะดำเนินการพร้อมกันกับการรักษาแบบหยุดยาหรือทันทีหลังการรักษา
- เพื่อป้องกันการเกิดซ้ำของมาลาเรียชนิดไวแวกซ์และมาลาเรียชนิดโอวาเลแบบเอริโทรไซต์ภายนอก เพื่อให้มีผลต่อฮิปโทโซอิต กำหนดให้ใช้ไพรมาควินในขนาด 45 มก. (เบส 27 มก.) ต่อวัน (3 เม็ด) เป็นเวลา 14 วัน หรือ 6 เม็ด สัปดาห์ละ 1 ครั้ง เป็นเวลา 6-8 สัปดาห์ (ในกรณีที่ขาดกลูโคส-6-ฟอสเฟตดีไฮโดรจีเนส) ยาทาเฟโนควินกำลังอยู่ในระหว่างการทดลองทางคลินิก ซึ่งเป็นยาแอนะล็อกของไพรมาควิน แต่มีประสิทธิภาพทางคลินิกสูงกว่าและมีผลข้างเคียงน้อยกว่า
- เพื่อป้องกันการแพร่กระจายของมาเลเรียจากเชื้อฟัลซิปารัม (โดยส่งผลต่อเซลล์สืบพันธุ์) ให้ใช้ไพรมาควิน 45 มก. (เบส 27 มก.) ต่อวัน (3 เม็ด) เป็นเวลา 3 วัน การรักษาจะดำเนินการในภูมิภาคที่มีมาเลเรียเขตร้อนระบาด เมื่อใช้ฟานซิดาร์ในการรักษาผู้ป่วยที่เป็นมาเลเรียจากเชื้อฟัลซิปารัม จะไม่กำหนดให้ใช้ไพรมาควิน เนื่องจากไพริเมทามีน ซึ่งเป็นส่วนหนึ่งของฟานซิดาร์ มีผลกับเซลล์สืบพันธุ์ของเชื้อฟัลซิปารัม
การรักษามาลาเรียฟัลซิปารัมที่รุนแรงและ/หรือซับซ้อนจะดำเนินการในหน่วยดูแลผู้ป่วยหนัก หากไม่สามารถให้ยาทางปากได้ ให้ทำการบำบัดทางหลอดเลือดด้วยยาต่อไปนี้:
- ควินินไดไฮโดรคลอไรด์ - 10-20 มก./กก. (สูงสุด 2.0 กรัมต่อวัน) ฉีดเข้าเส้นเลือดดำในสารละลายน้ำตาลกลูโคส 5% ปริมาตร 500 มล. ช้าๆ วันละ 2-3 ครั้ง จนกว่าผู้ป่วยจะหายจากอาการร้ายแรง จากนั้นให้ยารับประทานชนิดใดชนิดหนึ่งตามแผนการรักษามาลาเรียฟัลซิปารัมชนิดไม่มีภาวะแทรกซ้อน
- ภายใต้สภาวะที่ทันสมัย มีการใช้สมุนไพรชนิดใหม่ในบางประเทศเพื่อรักษามาลาเรียชนิดฟัลซิปารัมที่รุนแรง (ยาเหล่านี้ไม่ได้รับการรับรองในรัสเซีย): อาร์เทเมเธอร์ (Artenam) - 160 มิลลิกรัม ฉีดเข้ากล้ามเนื้อในวันแรก จากนั้น 80 มิลลิกรัม เป็นเวลา 6 วัน อาร์เทซูเนต - 50 มิลลิกรัม ฉีดเข้ากล้ามเนื้อ (ทางเส้นเลือดดำ) วันละ 2 ครั้ง เป็นเวลา 7 วัน อาร์เทมิซินีน - 1,200 มิลลิกรัม ฉีดเข้ากล้ามเนื้อ เป็นเวลา 7 วัน
การรักษาโรคมาลาเรียตามกลไกการก่อโรคขึ้นอยู่กับความรุนแรงของโรคมาลาเรียและการเกิดภาวะแทรกซ้อน โดยกำหนดให้มีการบำบัดด้วยการล้างพิษ การแก้ไขกรดเกินในเลือด ภาวะน้ำตาลในเลือดต่ำ ยาขับปัสสาวะ ยาแก้แพ้ กลูโคคอร์ติโคสเตียรอยด์ (ตามที่ระบุ) วิตามิน ยาสำหรับหลอดเลือดหัวใจและยาอื่นๆ ในกรณีของภาวะปัสสาวะไม่ออก อาจทำการฟอกไตทางช่องท้องได้ ในการรักษาไข้ฮีโมโกลบินยูริก ก่อนอื่น ให้หยุดใช้ยาที่ทำให้เม็ดเลือดแดงแตก และทำการถ่ายเลือดจำนวนมาก
ผู้ป่วยที่หายป่วยแล้วสามารถกลับบ้านได้หลังจากการรักษาปรสิตวิทยาแบบครบชุด (หยุดการรักษา) โดยมีผลเลือดเป็นลบ 2-3 ครั้ง (หยดเลือดข้น) ผู้ป่วยที่เคยเป็นมาลาเรียชนิดไวแวกซ์และมาลาเรียชนิดโอวาเลสามารถเข้ารับการรักษาต่อเนื่องด้วยไพรมาควินแบบผู้ป่วยนอกได้ ผู้ป่วยที่เคยเป็นมาลาเรียจะได้รับการติดตามผลเป็นเวลา 1-1.5 เดือน โดยทำการตรวจปรสิตวิทยาซ้ำโดยใช้เลือดหยดหนาทุกๆ 7-10 วัน ผู้ป่วยที่เคยเป็นมาลาเรียชนิดไวแวกซ์ มาลาเรียชนิดโอวาเล และมาลาเรียชนิดมาเลเรียชนิดมาเลเรียอี จะได้รับการติดตามผลเป็นเวลา 2 ปี โดยต้องทำการตรวจปรสิตวิทยาซ้ำโดยใช้เลือดหยดหนาทุกครั้งที่อุณหภูมิเพิ่มขึ้น
การป้องกัน
องค์การอนามัยโลกกำลังต่อสู้กับมาเลเรียทั่วโลกภายใต้กรอบโครงการ Roll Back Malaria Programme ที่นำมาใช้ในปี 2541 ปัจจุบัน องค์การอนามัยโลกได้กำหนดเป้าหมายใหม่สำหรับภูมิภาคยุโรป นั่นคือ การกำจัดมาเลเรียสามวัน (P. vivax) ภายในปี 2553 และมาเลเรียเขตร้อนภายในปี 2558 ความเชื่อมโยงที่สำคัญที่สุดในมาตรการที่ซับซ้อนนี้ คือ การตรวจจับและการรักษาแหล่งที่มาของการติดเชื้ออย่างทันท่วงที
มาตรการป้องกันการระบาดมีจุดมุ่งหมายเพื่อตรวจจับและรักษาโรคมาลาเรียอย่างทันท่วงที รวมถึงพาหะของปรสิต (แหล่งที่มาของการติดเชื้อ) ตลอดจนต่อสู้กับพาหะโรคมาลาเรีย ปัจจุบันยังไม่มีวัคซีนที่มีประสิทธิภาพในการสร้างภูมิคุ้มกันโรคมาลาเรีย
การป้องกันมาเลเรียแบบรายบุคคลในระหว่างที่อยู่ในพื้นที่ที่มีการระบาดของโรคมีจุดมุ่งหมายเพื่อป้องกันการติดเชื้อและป้องกันการโจมตีของมาเลเรีย การป้องกันการติดเชื้อประกอบด้วยการใช้มาตรการป้องกันการถูกยุงกัด (ใช้สารขับไล่ ติดมุ้งที่หน้าต่างและประตู ม่านเตียง เสื้อผ้าที่ปกปิดแขนและขาเมื่ออยู่กลางแจ้งในตอนเย็นและตอนกลางคืน) ตามคำแนะนำขององค์การอนามัยโลก การป้องกันการโจมตีของมาเลเรียประกอบด้วยการใช้ยาป้องกันมาเลเรีย แนะนำเฉพาะกับบุคคลที่ไม่มีภูมิคุ้มกันที่เดินทางไปยังพื้นที่ที่มีความเสี่ยงสูงต่อการติดเชื้อมาเลเรียและขาดการดูแลทางการแพทย์ที่เข้าถึงได้ (สถานพยาบาลอยู่ห่างไกล ไม่สามารถตรวจเลือดหามาเลเรียได้อย่างรวดเร็ว)
ความจำเป็นในการใช้ ระยะเวลา และความถี่ในการใช้ยาจะพิจารณาหลังจากปรึกษากับผู้เชี่ยวชาญด้านโรคติดเชื้อเท่านั้น สิ่งสำคัญคือต้องระบุข้อห้ามในการใช้ยาเคมีบำบัด การมีโรคร้ายแรงร่วมด้วย สตรีมีครรภ์ที่ไม่มีภูมิคุ้มกัน เด็กเล็ก ไม่ควรไปเยี่ยมชมพื้นที่ที่มีโรคมาลาเรียระบาด
เนื่องจากเชื้อ Pl. falciparum มีความต้านทานต่อคลอโรควินสูง มาตรฐานในการป้องกันมาเลเรียจากเชื้อ falciparum ตามคำแนะนำของ WHO ในปัจจุบันคือเมฟโลควิน (250 มก. สัปดาห์ละครั้ง 2 สัปดาห์ก่อนออกเดินทางไปยังพื้นที่ที่มีการระบาด และ 4 สัปดาห์หลังจากเดินทางกลับ) การใช้ยาอื่นๆ (ด็อกซีไซคลิน คลอโรควินร่วมกับโปรกวนิล อะโทวาควินร่วมกับโปรกวนิล ไพรมาควิน และอื่นๆ) จะพิจารณาโดยผู้เชี่ยวชาญด้านโรคติดเชื้อโดยคำนึงถึงสถานการณ์ทางระบาดวิทยาในพื้นที่ที่เข้าพักและปัจจัยอื่นๆ ที่กล่าวข้างต้น
พยากรณ์
ในกรณีส่วนใหญ่ การเสียชีวิตมักเกิดจากมาเลเรียเขตร้อน หรือพูดให้ชัดเจนกว่านั้นคือ มาเลเรียที่เกิดในสมอง ซึ่งเกิดขึ้นในผู้ป่วยมาเลเรียฟัลซิปารัมรุนแรงร้อยละ 10 การเสียชีวิตจากมาเลเรียชนิดอื่นพบได้น้อยมาก แต่หากได้รับการวินิจฉัยอย่างทันท่วงทีและได้รับการรักษามาเลเรียอย่างเหมาะสม จะทำให้หายขาดได้ในที่สุด
สำหรับผู้ป่วยที่เป็นมาเลเรียเขตร้อน แนะนำให้เฝ้าสังเกตอาการที่คลินิกเป็นเวลา 1-1.5 เดือน และตรวจเลือดทางปรสิตทุกๆ 1-2 สัปดาห์ ควรเฝ้าสังเกตอาการผู้ป่วยที่เป็นมาเลเรียจากเชื้อ P. vivax. P. ovale. P. malariae เป็นเวลา 2 ปี หากอุณหภูมิร่างกายสูงขึ้น จำเป็นต้องตรวจเลือดทางห้องปฏิบัติการเพื่อระบุพลาสโมเดียของมาเลเรียได้ทันท่วงที

