ผู้เชี่ยวชาญทางการแพทย์ของบทความ
สิ่งตีพิมพ์ใหม่
แบบจำลองการทดลองของโรคข้อเข่าเสื่อม
ตรวจสอบล่าสุด: 07.07.2025

เนื้อหา iLive ทั้งหมดได้รับการตรวจสอบทางการแพทย์หรือตรวจสอบข้อเท็จจริงเพื่อให้แน่ใจว่ามีความถูกต้องตามจริงมากที่สุดเท่าที่จะเป็นไปได้
เรามีแนวทางการจัดหาที่เข้มงวดและมีการเชื่อมโยงไปยังเว็บไซต์สื่อที่มีชื่อเสียงสถาบันการวิจัยทางวิชาการและเมื่อใดก็ตามที่เป็นไปได้ โปรดทราบว่าตัวเลขในวงเล็บ ([1], [2], ฯลฯ ) เป็นลิงก์ที่คลิกได้เพื่อการศึกษาเหล่านี้
หากคุณรู้สึกว่าเนื้อหาใด ๆ ของเราไม่ถูกต้องล้าสมัยหรือมีข้อสงสัยอื่น ๆ โปรดเลือกแล้วกด Ctrl + Enter
กระดูกอ่อนเป็นเนื้อเยื่อที่มีความเฉพาะทางสูงซึ่งประกอบด้วยเซลล์เพียงชนิดเดียว (คอนโดรไซต์) และมีลักษณะเฉพาะคือไม่มีเลือดและหลอดน้ำเหลือง กระดูกอ่อนได้รับสารอาหารหลักจากการดูดซึมจากของเหลวในข้อ การเผาผลาญคอนโดรไซต์ถูกควบคุมโดยปัจจัยที่ละลายน้ำได้จำนวนหนึ่งที่ผลิตขึ้นในท้องถิ่นโดยคอนโดรไซต์และเนื้อเยื่อโดยรอบ การทำงานของคอนโดรไซต์ยังขึ้นอยู่กับองค์ประกอบของสภาพแวดล้อมนอกเซลล์ (ความตึงของออกซิเจน ความเข้มข้นของไอออน ค่า pH เป็นต้น) องค์ประกอบของ ECM ปฏิสัมพันธ์ระหว่างเซลล์และเมทริกซ์ และสัญญาณทางกายภาพ วัตถุประสงค์หลักของการสร้างแบบจำลองในการทดลองคือการสร้างวัฒนธรรมในสภาพแวดล้อมนอกเซลล์โดยไม่เปลี่ยนลักษณะปรากฏของเซลล์ที่โตเต็มที่ วัตถุประสงค์ที่สองคือการสร้างวัฒนธรรมเพื่อศึกษาการตอบสนองก่อนวัยอันควร ล่าช้า ระยะสั้น หรือยาวนานของคอนโดรไซต์ต่อสัญญาณทางเคมีและ/หรือทางกายภาพ การศึกษาในหลอดทดลองยังให้โอกาสในการศึกษาพฤติกรรมของคอนโดรไซต์ในโรคข้อเสื่อม วัตถุประสงค์ที่สามคือการพัฒนาระบบการเพาะเลี้ยงร่วมกันที่ช่วยให้สามารถศึกษาปฏิสัมพันธ์ของเนื้อเยื่อต่างๆ ในข้อต่อได้ งานที่สี่คือการเตรียมกระดูกอ่อนสำหรับการปลูกถ่ายครั้งต่อไป และสุดท้าย งานที่ห้าคือการศึกษาปัจจัยการเจริญเติบโต ไซโตไคน์ หรือตัวแทนการรักษาที่สามารถกระตุ้นการซ่อมแซมและ/หรือยับยั้งการสลายของกระดูกอ่อน
ในช่วงหลายทศวรรษที่ผ่านมา มีการสร้างแบบจำลองต่างๆ ของการเพาะเลี้ยงเซลล์กระดูกอ่อนในข้อต่อ ได้แก่ การเพาะเลี้ยงเซลล์ชั้นเดียว การเพาะเลี้ยงเซลล์แขวนลอย การเพาะเลี้ยงกระดูกอ่อน เซลล์ที่ปลูกถ่าย การเพาะเลี้ยงร่วม และการเพาะเลี้ยงเซลล์อมตะ การเพาะเลี้ยงแต่ละแบบมีข้อดีและข้อเสียของตัวเอง และแต่ละแบบเหมาะสำหรับการศึกษาลักษณะเฉพาะอย่างหนึ่งของการเผาผลาญเซลล์กระดูกอ่อน ดังนั้น การเพาะเลี้ยงเซลล์กระดูกอ่อนจึงเป็นแบบจำลองที่ยอดเยี่ยมสำหรับการศึกษาการหมุนเวียนขององค์ประกอบเมทริกซ์ ซึ่งต้องมีตัวรับบนพื้นผิวเซลล์ที่แท้จริง และปฏิสัมพันธ์ระหว่างเซลล์-เมทริกซ์และเมทริกซ์-เซลล์ปกติ ในขณะเดียวกัน ขอแนะนำให้ศึกษาการสะสมของเมทริกซ์หรือกลไกที่ควบคุมการเผาผลาญเซลล์กระดูกอ่อนในการเพาะเลี้ยงเซลล์ที่แยกจากกัน การเพาะเลี้ยงเซลล์ชั้นเดียวที่มีความหนาแน่นต่ำมีความจำเป็นสำหรับการศึกษากระบวนการแบ่งตัวของเซลล์ การเพาะเลี้ยงเซลล์ที่แขวนลอยในเมทริกซ์ธรรมชาติหรือสังเคราะห์เป็นแบบจำลองสำหรับการวิเคราะห์การตอบสนองแบบปรับตัวของเซลล์กระดูกอ่อนต่อความเครียดเชิงกล
การเพาะเลี้ยงเซลล์กระดูกอ่อน
การเลือกเนื้อเยื่อกระดูกอ่อนสำหรับการศึกษาในหลอดทดลองควรคำนึงถึงประเด็นสำคัญหลายประการ องค์ประกอบของเมทริกซ์และกิจกรรมการเผาผลาญของคอนโดรไซต์แตกต่างกันไปในแต่ละข้อต่อ และหลังยังขึ้นอยู่กับความลึกของตำแหน่งคอนโดรไซต์ในเนื้อเยื่อด้วย ข้อมูลเหล่านี้ได้รับจากการทดลองหลายครั้งซึ่งศึกษากลุ่มย่อยของคอนโดรไซต์ที่แยกจากโซนกระดูกอ่อนที่มีความลึกต่างกัน พบความแตกต่างทางสัณฐานวิทยาและชีวเคมีหลายประการระหว่างคอนโดรไซต์ที่เพาะเลี้ยงซึ่งตั้งอยู่ในชั้นผิวเผินและชั้นลึกของกระดูกอ่อนข้อต่อ เซลล์ผิวเผินสร้างเมทริกซ์ของเส้นใยบางๆ ที่มีโปรตีโอไกลแคนน้อย ในขณะที่เซลล์ที่ลึกกว่าจะสร้างเมทริกซ์ที่มีเส้นใยและโปรตีโอไกลแคนมาก นอกจากนี้ เซลล์ผิวเผินสร้างโปรตีโอไกลแคนและกรดไฮยาลูโรนิกที่ไม่รวมตัวกันซึ่งมีขนาดเล็กกว่าเมื่อเทียบกัน และมีแอกกรีแคนและเคอราแทนซัลเฟตน้อยกว่าเมื่อเทียบกันในคอนโดรไซต์ที่ลึกกว่า ลักษณะเด่นที่สำคัญอีกประการหนึ่งของการเผาผลาญเซลล์กระดูกอ่อนที่แยกจากบริเวณกระดูกอ่อนที่มีความลึกต่างกันคือการตอบสนองต่อสิ่งกระตุ้นจากภายนอก ตามที่ M. Aydelotte et al. ระบุ เซลล์กระดูกอ่อนของวัวจากบริเวณผิวเผินของกระดูกอ่อนมีความไวต่อ IL-1 มากกว่าเซลล์จากบริเวณลึก
พฤติกรรมของเซลล์ยังขึ้นอยู่กับตำแหน่งของเนื้อเยื่อด้วย เซลล์กระดูกอ่อนจากกระดูกซี่โครงและกระดูกอ่อนหูจากสัตว์ชนิดเดียวกันตอบสนองต่อปัจจัยการเจริญเติบโต เช่น ปัจจัยการเจริญเติบโตของไฟโบรบลาสต์ (FGF) และ TGF-beta แตกต่างกัน FGF เพิ่มการรวมตัวของไทมิดีน โพรลีน และลูซีนในซี่โครงที่เพาะเลี้ยง แต่ไม่เพิ่มการรวมตัวของไทมิดีนในเซลล์กระดูกอ่อนหู TGF-beta เพิ่มการรวมตัวของไทมิดีนในเซลล์กระดูกอ่อนซี่โครงและหู แต่ไม่มีผลต่อการรวมตัวของไทมิดีนและโพรลีนในเซลล์กระดูกอ่อนหู เซลล์กระดูกอ่อนจากบริเวณที่มีแรงกดสูงจะแตกต่างจากเซลล์กระดูกอ่อนจากบริเวณที่มีแรงกดต่ำบนกระดูกอ่อน ดังนั้น เซลล์กระดูกอ่อนของแกะโตเต็มวัยจากบริเวณกลางของพื้นผิวข้อต่อของกระดูกแข้งที่ไม่ได้ถูกปกคลุมด้วยหมอนรองกระดูก ซึ่งเป็นส่วนที่รับน้ำหนักมากที่สุดในร่างกาย จะสังเคราะห์แอกกรีแคนน้อยกว่าแต่มีเดคอรินมากกว่าเซลล์จากบริเวณที่ถูกปกคลุมด้วยหมอนรองกระดูก ผู้เขียนยังเน้นย้ำถึงความสำคัญของการใช้กระดูกอ่อนจากบริเวณข้อต่อที่เหมือนกันเมื่อศึกษาฟังก์ชันสังเคราะห์ของข้อต่อ
การเผาผลาญของเซลล์กระดูกอ่อนและการตอบสนองต่อปัจจัยควบคุมยังขึ้นอยู่กับอายุของผู้บริจาค การพัฒนาโครงกระดูก และสภาพของข้อต่อที่นำเซลล์มาด้วย ในเซลล์กระดูกอ่อนของมนุษย์ พบว่าการตอบสนองของเซลล์กระดูกอ่อนลดลงอย่างมีนัยสำคัญเมื่ออายุมากขึ้น โดยพบการลดลงมากที่สุดในผู้บริจาคที่มีอายุ 40-50 ปีและมากกว่า 60 ปี นอกจากนี้ ความรุนแรงของการตอบสนองของเซลล์กระดูกอ่อนต่อปัจจัยการเจริญเติบโต (เช่น FGF และ TGF-beta) จะลดลงเมื่ออายุมากขึ้น นอกจากการเปลี่ยนแปลงเชิงปริมาณในการเพิ่มจำนวนของเซลล์กระดูกอ่อนแล้ว ยังมีการเปลี่ยนแปลงเชิงคุณภาพอีกด้วย เซลล์จากผู้บริจาคที่อายุน้อย (10-20 ปี) ตอบสนองต่อปัจจัยการเจริญเติบโตที่ได้จากเกล็ดเลือด (PDGF) ได้ดีกว่า TGF-beta ในขณะที่เซลล์จากผู้บริจาคที่เป็นผู้ใหญ่กลับเป็นตรงกันข้าม มีการใช้กลไกหลายอย่างเพื่ออธิบายการเปลี่ยนแปลงที่ขึ้นกับอายุในการทำงานสังเคราะห์ของเซลล์กระดูกอ่อนและการตอบสนองต่อปัจจัยการเจริญเติบโต ซึ่งรวมถึงการลดจำนวนและความสัมพันธ์ของตัวรับเซลล์บนพื้นผิว การเปลี่ยนแปลงในการสังเคราะห์และการทำงานทางชีวภาพของปัจจัยการเจริญเติบโตและไซโตไคน์ และการปรับเปลี่ยนสัญญาณหลังตัวรับ
ภาวะทางพยาธิวิทยาของข้อต่อยังเปลี่ยนแปลงสัณฐานวิทยาและกิจกรรมการเผาผลาญของเซลล์กระดูกอ่อนด้วย ดังนั้น J. Kouri et al. (1996) จึงระบุเซลล์กระดูกอ่อน 3 กลุ่มย่อยในกระดูกอ่อนในโรคข้อเสื่อม เซลล์กระดูกอ่อนจากชั้นผิวเผินและส่วนบนของกระดูกอ่อนตรงกลางจะรวมตัวกันเป็นกลุ่มและสังเคราะห์โปรตีโอกลีแคนและคอลลาเจนในปริมาณที่มากขึ้น TGF-beta และอินซูลินไลค์โกรทแฟกเตอร์ (IGF) สามารถกระตุ้นการสังเคราะห์โปรตีโอกลีแคนโดยเซลล์กระดูกอ่อนและทำให้ผลของ IL-1 และ TNF-a เป็นกลางได้บางส่วน เนื้อเยื่อกระดูกอ่อนที่ได้รับผลกระทบจากโรคข้อเสื่อมและเซลล์กระดูกอ่อนที่แยกจากกระดูกอ่อนของผู้ป่วยโรคข้อเสื่อมมีความไวต่อการกระตุ้นของ TGF-beta มากกว่าเซลล์กระดูกอ่อนของกระดูกอ่อนที่แข็งแรง ความแตกต่างเหล่านี้น่าจะเกี่ยวข้องกับการเปลี่ยนแปลงทางฟีโนไทป์ของเซลล์กระดูกอ่อนในชั้นบนของกระดูกอ่อนข้อต่อ
การแยกเซลล์กระดูกอ่อนแต่ละเซลล์ทำได้โดยการบำบัด ECM ตามลำดับด้วยเอนไซม์โปรตีโอไลติก หลังจากเซลล์เหล่านี้ถูกปลดปล่อยออกจาก ECM แล้ว เซลล์ที่แยกออกมาจะเหมาะอย่างยิ่งสำหรับการศึกษาการสังเคราะห์ส่วนประกอบของเมทริกซ์ใหม่ ผู้เขียนบางคนใช้เฉพาะคอลลาจิเนสจากคลอสตริเดียม ในขณะที่บางคนฟักกระดูกอ่อนไว้ล่วงหน้าด้วยทริปซิน โพรเนส ดีเอ็นเอส และ/หรือไฮยาลูโรนิเดส จำนวนเซลล์ที่แยกออกมาขึ้นอยู่กับเอนไซม์ที่ใช้ ดังนั้น เมื่อบำบัดด้วยคอลลาจิเนสเพียงอย่างเดียว จะสามารถแยกเซลล์กระดูกอ่อนได้ 1.4-10 6จากเนื้อเยื่อ 1 กรัม ในขณะที่ใช้โพรเนส ไฮยาลูโรนิเดส และคอลลาจิเนส - 4.3-10 6เมื่อบำบัดด้วยคอลลาจิเนส แอกกรีแคน โปรตีน IL-6 และ IL-8 จะยังคงอยู่ในเซลล์เพาะเลี้ยงในปริมาณที่มากกว่าอย่างมีนัยสำคัญเมื่อเทียบกับการบำบัดตามลำดับด้วยเอนไซม์ที่แตกต่างกัน มีคำอธิบายหลายประการสำหรับความแตกต่างระหว่างเซลล์เพาะเลี้ยงทั้งสองชนิดนี้:
- ตัวรับเซลล์ได้รับความเสียหายหรือถูกยับยั้งโดยเอนไซม์ TGF-beta ยับยั้งการสังเคราะห์ DNA และโปรตีโอไกลแคนในคอนโดรไซต์ที่เพิ่งแยกออกมาใหม่ (วันที่ 1) ในขณะที่การสังเคราะห์ DNA และโปรตีโอไกลแคนในคอนโดรไซต์ที่เพาะเลี้ยงในโมโนเลเยอร์ (7 วัน) จะถูกกระตุ้นโดย TGF-beta อย่างไรก็ตาม จำเป็นต้องมีช่วงเวลาที่เหมาะสมสำหรับการแสดงออกซ้ำของส่วนประกอบของเยื่อหุ้มเซลล์เหล่านี้ก่อนเริ่มการทดลอง
- โปรตีเอสจากภายนอกสามารถขัดขวางการโต้ตอบระหว่างเซลล์กับเมทริกซ์ที่เกิดจากอินทีกริน กลุ่มของอินทีกรินจะส่งเสริมการยึดเกาะของคอนโดรไซต์กับโมเลกุล ECM (Shakibaei M. et al., 1997) การขัดขวางนี้สามารถส่งผลต่อการแสดงออกของยีนเมทริกซ์
- ส่วนประกอบของเมทริกซ์ที่เหลือสามารถควบคุมหน้าที่การสังเคราะห์ของคอนโดรไซต์ อินทิกรินสามารถจดจำผลิตภัณฑ์จากการย่อยสลายของ ECM จึงมีบทบาทสำคัญในการซ่อมแซมเนื้อเยื่อหลังจากการทำงานของเอนไซม์โปรตีโอไลติก T. Larsson et al. (1989) รายงานว่าการเพิ่มโปรตีโอกลีแคนที่สมบูรณ์หรือแตกเป็นชิ้นเล็กชิ้นน้อยลงในเซลล์เพาะเลี้ยงช่วยกระตุ้นการสังเคราะห์โปรตีนและโปรตีโอกลีแคน อย่างไรก็ตาม กรดไฮยาลูโรนิกในระดับสูงทำให้การรวมตัวของซัลเฟตในการสังเคราะห์โปรตีโอกลีแคนโดยคอนโดรไซต์ของตัวอ่อนไก่ คอนโดรไซต์ที่โตเต็มที่ของเซลล์มะเร็งคอนโดรซาร์โคมาของหมูและหนูลดลงอย่างมีนัยสำคัญ นอกจากนี้ กรดไฮยาลูโรนิกยังเป็นสารยับยั้งการปลดปล่อยโปรตีโอกลีแคนจากเซลล์แม้จะมี IL-1b, TNF-a, FGF ซึ่งบ่งชี้ถึงการต่อต้านกิจกรรมทางชีวภาพครั้งแรกของปัจจัยการเจริญเติบโตและไซโตไคน์ กลไกที่ชัดเจนเบื้องหลังการทำงานของกรดไฮยาลูโรนิกยังคงไม่ชัดเจน เป็นที่ทราบกันดีว่าคอนโดรไซต์มีตัวรับกรดไฮยาลูโรนิกที่เกี่ยวข้องกับเส้นใยแอคตินของไซโทซอล การจับกันของกรดไฮยาลูโรนิกกับตัวรับจะกระตุ้นการฟอสโฟรีเลชันของโปรตีน ดังนั้น ข้อมูลเหล่านี้จึงแสดงให้เห็นการปรับการทำงานของเมแทบอลิซึมของคอนโดรไซต์โดยโมเลกุลของโปรตีนเมทริกซ์ที่แตกเป็นชิ้นเล็กชิ้นน้อยหรือดั้งเดิมผ่านการกระตุ้นตัวรับของเยื่อหุ้มเซลล์
- การกระตุ้นอย่างรวดเร็วของการสังเคราะห์โปรตีนเมทริกซ์โดยเซลล์กระดูกอ่อนด้วยเอนไซม์อาจเป็นผลจากการเปลี่ยนแปลงรูปร่างของเซลล์กระดูกอ่อนและ/หรือการจัดระเบียบใหม่ของโครงร่างเซลล์
- ไซโตไคน์บางชนิด (เช่น IL-8) และปัจจัยการเจริญเติบโต (เช่น IGF-1, TGF-β) ถูกกักเก็บใน ECM ตัวอย่างที่รู้จักกันดีที่สุดคือการจับกันของ TGF-β โดยเดโคริน ซึ่งส่งผลให้ความสามารถของไซโตไคน์ในการเหนี่ยวนำการเติบโตของเซลล์ในเซลล์รังไข่ของหนูแฮมสเตอร์จีนลดลง การค้นพบว่าปริมาณเดโครินในกระดูกอ่อนเพิ่มขึ้นตามอายุ แสดงให้เห็นว่าการดูดซึมของ TGF-β ลดลงตามอายุ ปัจจัยการเจริญเติบโตและไซโตไคน์อาจถูกปลดปล่อยจากเศษซากเมทริกซ์ในระหว่างการเพาะเลี้ยง และต่อมาปรับเปลี่ยนการทำงานของเซลล์กระดูกอ่อน
การเพาะเลี้ยงเซลล์กระดูกอ่อนแบบชั้นเดียว
ลักษณะทางฟีโนไทป์ที่แตกต่างของเซลล์กระดูกอ่อนนั้นมีลักษณะเฉพาะหลักๆ คือการสังเคราะห์คอลลาเจนชนิดที่ 2 และโปรตีโอกลีแคนเฉพาะเนื้อเยื่อ ตลอดจนกิจกรรมไมโทซิสในระดับต่ำ มีหลักฐานว่าด้วยการเพาะเลี้ยงเซลล์ในชั้นเดียวเป็นเวลานาน รวมถึงหลังจากผ่านเซลล์ซ้ำหลายครั้ง เซลล์กระดูกอ่อนจะสูญเสียรูปร่างทรงกลมและได้รูปร่างที่ยาวขึ้นคล้ายไฟโบรบลาสต์ ด้วยเมตาพลาเซียของไฟโบรบลาสต์ดังกล่าว หน้าที่ในการสังเคราะห์ของเซลล์ก็เปลี่ยนแปลงไปด้วย โดยมีลักษณะเฉพาะคือการสังเคราะห์คอลลาเจนชนิดที่ 2, IX และ XI ลดลงอย่างต่อเนื่อง และการสังเคราะห์คอลลาเจนชนิดที่ 1, III และ Y เพิ่มขึ้น มีการสังเคราะห์โปรตีโอกลีแคนขนาดเล็กที่ไม่รวมตัวกันเนื่องจากแอกกรีแคนที่ทำหน้าที่ได้ การสังเคราะห์แคธีปซิน B และ L นั้นต่ำมากในเซลล์ที่แยกแยะได้ แต่กระบวนการสูญเสียการแยกตัวจะเพิ่มขึ้น คอลลาจิเนส-1 ถูกแสดงออกในเซลล์กระดูกอ่อนที่แยกแยะได้ เมื่อเพาะเลี้ยงเป็นเวลานาน การแสดงออกจะลดลง ในขณะที่การผลิตสารยับยั้งเนื้อเยื่อเมทัลโลโปรตีเอส (TIMPs) จะเพิ่มขึ้น
เซลล์กระดูกอ่อนที่แยกความแตกต่างแล้วจะแสดงคอลลาเจนของฟีโนไทป์ที่แยกความแตกต่างแล้วอีกครั้งเมื่อถ่ายโอนจากเซลล์ชั้นเดียวไปยังเซลล์เพาะเลี้ยงแบบแขวนลอย กระบวนการแยกความแตกต่างอาจเกี่ยวข้องกับรูปร่างของเซลล์ คุณสมบัตินี้มักใช้โดยนักวิจัยที่ศึกษาการปลูกถ่ายที่มีข้อบกพร่องด้วยเซลล์กระดูกอ่อนของตัวเอง เซลล์จำนวนเล็กน้อยที่ได้จากวัสดุชิ้นเนื้อสามารถขยายพันธุ์ในเซลล์ชั้นเดียวแล้วนำกลับเข้าสู่เมทริกซ์สามมิติอีกครั้งก่อนการปลูกถ่าย การแสดงออกใหม่ของฟีโนไทป์เฉพาะโดยเซลล์กระดูกอ่อนที่แยกความแตกต่างแล้วซึ่งถ่ายโอนไปยังเซลล์เพาะเลี้ยงแบบอะกาโรสสามารถกระตุ้นได้ด้วย TGF-β คอมเพล็กซ์ออสเซน-ไฮดรอกซีอะพาไทต์ และกรดแอสคอร์บิก
ในการตอบสนองต่อปัจจัยการเจริญเติบโตและไซโตไคน์ คอนโดรไซต์จะถูกปรับเปลี่ยนในระหว่างกระบวนการสร้างความแตกต่าง การตอบสนองของเซลล์ต่อไซโตไคน์และปัจจัยการเจริญเติบโตจะแตกต่างกันระหว่างคอนโดรไซต์ที่ไม่แยกความแตกต่างและที่แยกความแตกต่างแล้ว IL-1 กระตุ้นการแบ่งตัวของไฟโบรบลาสต์ ในขณะที่การเติบโตของคอนโดรไซต์ที่ไม่แยกความแตกต่างจะถูกยับยั้งโดย IL-1 การสังเคราะห์ DNA จะถูกกระตุ้นโดย IGF-1 ในคอนโดรไซต์ที่ยาวแต่ไม่แบน ในคอนโดรไซต์ที่แยกความแตกต่างแล้ว ผลการกระตุ้นของ IL-1beta และ TNF-α ต่อการผลิตโปรคอลลาเจนจะเด่นชัดกว่าในคอนโดรไซต์ที่ไม่แยกความแตกต่าง
การเพาะเลี้ยงเซลล์กระดูกอ่อน
การเพาะเลี้ยงเซลล์กระดูกอ่อนในของเหลวหรือในเมทริกซ์สามมิติตามธรรมชาติหรือสังเคราะห์จะทำให้ลักษณะเฉพาะของเซลล์กระดูกอ่อนคงที่ เซลล์จะคงรูปทรงกลมและสังเคราะห์โปรตีนเฉพาะเนื้อเยื่อ การเพาะเลี้ยงเซลล์กระดูกอ่อนแบบแขวนลอยมักแนะนำให้ใช้ในการศึกษาการก่อตัวของเมทริกซ์รอบเซลล์ใหม่ การเพาะเลี้ยงเซลล์กระดูกอ่อนในพอลิเมอร์ดูดซับสังเคราะห์หรือธรรมชาติใช้สำหรับการปลูกถ่ายเซลล์เข้าไปในกระดูกอ่อนที่มีข้อบกพร่องเพื่อกระตุ้นการสร้างเนื้อเยื่อกระดูกอ่อนของข้อต่อใหม่ เซลล์ที่ปลูกถ่ายต้องเป็นไปตามข้อกำหนดหลายประการ:
- รากฟันเทียมจะต้องมีโครงสร้างที่มีรูพรุนเพื่อการยึดเกาะและการเจริญเติบโตของเซลล์
- ทั้งพอลิเมอร์เองและผลิตภัณฑ์สลายตัวไม่ควรทำให้เกิดการอักเสบหรือปฏิกิริยาพิษเมื่อปลูกถ่ายในร่างกาย
- ตัวนำกราฟต์ต้องสามารถยึดติดกับกระดูกอ่อนหรือกระดูกใต้กระดูกอ่อนที่อยู่ติดกันได้
- เมทริกซ์ธรรมชาติหรือสังเคราะห์จะต้องสามารถดูดซับได้ การย่อยสลายจะต้องสมดุลด้วยการสร้างเนื้อเยื่อใหม่
- เพื่ออำนวยความสะดวกในการซ่อมแซมกระดูกอ่อน โครงสร้างทางเคมีและโครงสร้างของรูพรุนของเมทริกซ์จะต้องอำนวยความสะดวกในการรักษาฟีโนไทป์ของเซลล์และการสังเคราะห์โปรตีนเฉพาะเนื้อเยื่อโดยคอนโดรไซต์ที่วางไว้ข้างใน
- ในระหว่างการฝังในร่างกาย จำเป็นต้องศึกษาคุณสมบัติเชิงกลของเมทริกซ์สังเคราะห์หรือธรรมชาติ
 [ 12 ], [ 13 ], [ 14 ], [ 15 ], [ 16 ]
[ 12 ], [ 13 ], [ 14 ], [ 15 ], [ 16 ]
การแขวนลอยของเซลล์กระดูกอ่อนในเฟสของเหลว
การเกาะติดของเซลล์กับภาชนะพลาสติกที่มีการเพาะเลี้ยงเซลล์กระดูกอ่อนสามารถป้องกันได้โดยการเคลือบผนังเซลล์ด้วยสารละลายเมทิลเซลลูโลส อะกาโรส ไฮโดรเจล (โพลี-2-ไฮดรอกซีเอทิลเมทาคริเลต) หรือส่วนผสมของคอลลาเจน-อะกาโรส ภายใต้เงื่อนไขเหล่านี้ เซลล์กระดูกอ่อนจะรวมตัวกันเป็นกลุ่มและสังเคราะห์คอลลาเจนเฉพาะเนื้อเยื่อและแอกกรีแคนเป็นหลัก (ประเภท II, IX, XI) โดยทั่วไปจะพบเซลล์ 2 ประเภท เซลล์ที่อยู่ตรงกลางจะมีรูปร่างเป็นทรงกลมและล้อมรอบด้วย ECM ที่พัฒนาดี ซึ่งได้รับการยืนยันจากการศึกษาทางฮิสโตเคมีและโครงสร้างจุลภาค ที่บริเวณรอบนอก เซลล์กระดูกอ่อนจะมีโครงร่างเป็นดิสก์และล้อมรอบด้วย ECM ที่เบาบาง เราทราบเพียงเล็กน้อยเกี่ยวกับลักษณะการทำงานของเซลล์ดังกล่าว
สามารถเพาะเลี้ยงคอนโดรไซต์บนไมโครแคริเออร์ที่เก็บรักษาในสารแขวนลอยได้ โดยใช้ลูกปัดเดกซ์แทรน (ไซโตเด็กซ์) ลูกปัดเดกซ์แทรนเคลือบคอลลาเจน (ไซโตเด็กซ์ III) และไมโครสเฟียร์คอลลาเจนชนิด I ที่ไม่มีรูพรุน (เซลลาเจน) เป็นไมโครแคริเออร์ ภายใต้เงื่อนไขการเพาะเลี้ยงเหล่านี้ คอนโดรไซต์จะเกาะติดกับพื้นผิวของไมโครแคริเออร์ รักษารูปร่างทรงกลมของมันไว้ และสร้างวัสดุคล้ายเมทริกซ์ นอกจากนี้ การใช้เซลลาเจนยังส่งเสริมการแบ่งตัวของคอนโดรไซต์และการแสดงออกของฟีโนไทป์ปกติอีกครั้ง ดังนั้น การเพาะเลี้ยงคอนโดรไซต์บนไมโครสเฟียร์เซลลาเจนจึงสามารถใช้เพื่อฟื้นฟูฟีโนไทป์ของเซลล์ก่อนการปลูกถ่าย
อีกวิธีหนึ่งในการเพาะเลี้ยงเซลล์กระดูกอ่อนในอาหารเหลวคือการเพาะเลี้ยงในรูปลูกบอลหนาแน่นที่ประกอบด้วยเซลล์ (0.5-1 * 10 b ) ซึ่งได้มาจากการปั่นเหวี่ยง เซลล์กระดูกอ่อนดังกล่าวสามารถผลิตเมทริกซ์ที่มีโปรตีโอกลีแคนจำนวนมาก คอลลาเจนชนิดที่ 2 แต่ไม่ใช่คอลลาเจนชนิดที่ 1 ซึ่งได้รับการยืนยันโดยวิธีการทางเนื้อเยื่อวิทยา ภูมิคุ้มกันเนื้อเยื่อ และเชิงปริมาณ
การแขวนลอยของเซลล์กระดูกอ่อนใน ECM ตามธรรมชาติ
สามารถเพาะเลี้ยงเซลล์กระดูกอ่อนในรูปแบบแขวนลอยในเมทริกซ์สามมิติได้ (วุ้นอ่อน อะกาโรส เจลคอลลาเจนหรือฟองน้ำ กรดไฮยาลูโรนิก กาวไฟบริน ลูกปัดอัลจิเนต)
เซลล์กระดูกอ่อนที่เพาะเลี้ยงในอะกาโรสยังคงลักษณะปกติและสังเคราะห์คอลลาเจนชนิดที่ 2 และกลุ่มของแอกกรีแคนที่จำเพาะต่อเนื้อเยื่อ เมื่อเพาะเลี้ยงในอะกาโรส โปรตีโอกลีแคนที่สังเคราะห์โดยเซลล์จะถูกปล่อยลงในอาหารเลี้ยงเชื้อเป็นเวลา 50 วัน เมื่อเปรียบเทียบกันแล้ว ในการเพาะเลี้ยงแบบโมโนเลเยอร์ เฟสของเซลล์จะเต็มไปด้วยไกลโคสะมิโนกลีแคนตั้งแต่ 5-6 วันแรกของการเพาะเลี้ยงแล้ว เมื่อเพาะเลี้ยงในอาหารเลี้ยงเชื้อ หลังจากการสังเคราะห์และการปล่อยไกลโคสะมิโนกลีแคนที่เพิ่มขึ้นใน 8-10 วันแรก การลดลงของไกลโคสะมิโนกลีแคนจะเกิดขึ้นตามเวลา อย่างไรก็ตาม พฤติกรรมของเซลล์กระดูกอ่อนเมื่อเพาะเลี้ยงในอะกาโรสจะแตกต่างจากในร่างกาย ในอะกาโรส กลุ่มของแอกกรีแคนที่สังเคราะห์จำนวนมากจะมีโมเลกุลที่เล็กกว่าและมีจำนวนโมเลกุลน้อยกว่าในร่างกาย TGF-β กระตุ้นการสังเคราะห์โปรตีโอกลีแคนในชิ้นส่วน แต่จะลดการสังเคราะห์แอกกรีแคนในอะกาโรส
อัลจิเนตเป็นโพลีแซ็กคาไรด์เชิงเส้นที่ได้จากสาหร่ายทะเลสีน้ำตาล ในสภาพที่มีไอออนบวกสองประจุ เช่น ไอออน Ca 2+พอลิเมอร์นี้จะกลายเป็นเจล เซลล์กระดูกอ่อนแต่ละเซลล์ที่ติดอยู่ในอัลจิเนตจะถูกล้อมรอบด้วยเมทริกซ์ของโพลีแซ็กคาไรด์ที่มีประจุลบ ซึ่งรูพรุนนั้นเทียบได้กับรูพรุนในกระดูกอ่อนใส เมทริกซ์ที่เกิดจากเซลล์กระดูกอ่อนในเม็ดอัลจิเนตประกอบด้วยช่องสองช่อง ได้แก่ ชั้นบางๆ ของเมทริกซ์ที่เกี่ยวข้องกับเซลล์ซึ่งสอดคล้องกับเมทริกซ์รอบเซลล์และบริเวณของกระดูกอ่อนข้อต่อ และเมทริกซ์ที่อยู่ไกลออกไปซึ่งเทียบเท่ากับเมทริกซ์ระหว่างบริเวณในเนื้อเยื่อดั้งเดิม ในวันที่ 30 ของการเพาะเลี้ยง ปริมาตรสัมพัทธ์และสัมบูรณ์ที่ครอบครองโดยเซลล์และช่องทั้งสองในเม็ดอัลจิเนตแทบจะเหมือนกันทุกประการกับปริมาตรในกระดูกอ่อนดั้งเดิม เป็นเวลาเกือบ 30 วัน เซลล์กระดูกอ่อนจะคงรูปทรงกลมและผลิตแอกกรีแคน ซึ่งมีคุณสมบัติทางอุทกพลศาสตร์คล้ายกับโมเลกุลแอกกรีแคนในเมทริกซ์กระดูกอ่อนข้อต่อ รวมถึงโมเลกุลคอลลาเจนประเภท II, IX และ XI ในเวลาเดียวกัน เช่นเดียวกับวัฒนธรรมการแขวนลอยอื่นๆ เซลล์ที่แบนราบจะปรากฏอยู่บนพื้นผิวของเม็ดอัลจิเนต ซึ่งผลิตโมเลกุลคอลลาเจนประเภท I จำนวนเล็กน้อย ซึ่งจะถูกปล่อยลงในตัวกลางโดยตรงและไม่ถูกรวมเข้ากับ ECM เซลล์กระดูกอ่อนจะขยายตัวในระดับปานกลางในเม็ดอัลจิเนต หลังจากเพาะเลี้ยงในเจลอัลจิเนตเป็นเวลา 8 เดือน เซลล์กระดูกอ่อนที่โตเต็มที่จะไม่สูญเสียกิจกรรมการเผาผลาญและยังคงสังเคราะห์คอลลาเจนประเภท II และแอกกรีแคนที่จำเพาะต่อเนื้อเยื่อต่อไป
H. Tanaka และคณะ (1984) ศึกษาคุณสมบัติการแพร่กระจายของโมเลกุลธรรมชาติต่างๆ ในอัลจิเนตและพบว่าโมเลกุลที่มีขนาดใหญ่กว่า 70 kDa ไม่สามารถแพร่กระจายผ่านอัลจิเนตได้ ดังนั้น การเพาะเลี้ยงเซลล์ในอัลจิเนตจึงเหมาะสำหรับการศึกษาการควบคุมการสังเคราะห์เมทริกซ์และการจัดระเบียบของ ECM ความพร้อมของเซลล์ที่เพาะเลี้ยงในอัลจิเนตทำให้สามารถศึกษาการทำงานของปัจจัยควบคุมเปปไทด์และตัวแทนทางเภสัชวิทยาในระดับการถอดรหัส หลังการถอดรหัส และการแปลรหัส
นอกจากนี้ เซลล์กระดูกอ่อนยังได้รับการเพาะเลี้ยงในเมทริกซ์ของเส้นใยคอลลาเจนประเภท I และ II S. Nehrer และคณะ (1997) ได้เปรียบเทียบการทำงานของเซลล์กระดูกอ่อนของสุนัขในเมทริกซ์โพลีเมอร์คอลลาเจน-โปรตีโอไกลแคนที่มีรูพรุนซึ่งประกอบด้วยคอลลาเจนประเภทต่างๆ พวกเขาพบความแตกต่างที่สำคัญในสัณฐานวิทยาของหน้าที่การสังเคราะห์ของเซลล์กระดูกอ่อนที่เพาะเลี้ยงในเมทริกซ์คอลลาเจนที่มีคอลลาเจนประเภท I และ II เซลล์ในเมทริกซ์ของคอลลาเจนประเภท II ยังคงรูปทรงกลมไว้ ในขณะที่เซลล์คอลลาเจนประเภท I มีสัณฐานวิทยาคล้ายไฟโบรบลาสต์ ยิ่งไปกว่านั้น ในเมทริกซ์ของคอลลาเจนประเภท II เซลล์กระดูกอ่อนผลิตไกลโคสะมิโนไกลแคนได้มากกว่า J. van Susante และคณะ (1995) ได้เปรียบเทียบคุณสมบัติของเซลล์กระดูกอ่อนที่เพาะเลี้ยงในอัลจิเนตและเจลคอลลาเจน (ประเภท I) ผู้เขียนพบว่าจำนวนเซลล์ในเจลคอลลาเจนเพิ่มขึ้นอย่างมีนัยสำคัญ แต่ตั้งแต่วันที่ 6 ของการเพาะเลี้ยง เซลล์จะสูญเสียลักษณะเฉพาะตัว กลายเป็นเซลล์ที่คล้ายไฟโบรบลาสต์ ในเจลอัลจิเนต พบว่าจำนวนเซลล์ลดลง แต่คอนโดรไซต์ยังคงลักษณะปกติ ในเจลคอลลาเจน จำนวนโปรตีโอกลีแคนต่อเซลล์สูงกว่าในอัลจิเนตอย่างมีนัยสำคัญ แต่ในเจล พบว่าการสังเคราะห์องค์ประกอบเมทริกซ์ลดลง เริ่มตั้งแต่วันที่ 6 ของการเพาะเลี้ยง ในขณะที่ในอัลจิเนต การสังเคราะห์ยังคงเพิ่มขึ้นอย่างต่อเนื่อง
เมทริกซ์ไฟบรินสามมิติแบบแข็งเป็นสารธรรมชาติที่รองรับเซลล์กระดูกอ่อนที่แขวนลอยอยู่ในนั้นในลักษณะที่มีการแยกความแตกต่าง เมทริกซ์ไฟบรินสามมิติยังสามารถใช้เป็นตัวพาในการปลูกถ่ายเซลล์กระดูกอ่อนได้ ข้อดีของไฟบรินคือไม่มีพิษต่อเซลล์ ความสามารถในการเติมเต็มช่องว่าง และความสามารถในการยึดเกาะ การศึกษาทางเนื้อเยื่อวิทยาและชีวเคมี ออโตราดิโอแกรม และกล้องจุลทรรศน์อิเล็กตรอนแสดงให้เห็นว่าเซลล์กระดูกอ่อนในเจลไฟบรินยังคงรูปร่างเดิม ขยายพันธุ์ และสร้างเมทริกซ์ได้แม้จะผ่านการเพาะเลี้ยงเป็นเวลา 2 สัปดาห์ อย่างไรก็ตาม G. Homminga และคณะ (1993) รายงานว่าการสลายตัวของไฟบรินเริ่มขึ้นหลังจากการเพาะเลี้ยง 3 วัน และการแยกความแตกต่างของเซลล์กระดูกอ่อนก็ดำเนินไป
การแขวนลอยของเซลล์กระดูกอ่อนใน ECM เทียม (สังเคราะห์)
การฝังกระดูกอ่อนเพื่อการผ่าตัดสร้างใหม่หรือศัลยกรรมกระดูกสามารถทำได้โดยการปลูกถ่ายเซลล์กระดูกอ่อนที่แยกออกมาในหลอดทดลองในเมทริกซ์สังเคราะห์ที่เข้ากันได้ทางชีวภาพ
เซลล์กระดูกอ่อนที่เพาะเลี้ยงในกรดโพลีไกลโคลิกจะขยายตัวและรักษารูปร่างและลักษณะปกติเป็นเวลา 8 สัปดาห์ คอมเพล็กซ์เซลล์กระดูกอ่อน-กรดโพลีไกลโคลิกประกอบด้วยเซลล์ ไกลโคซามิโนไกลแคน คอลลาเจน และมีแคปซูลคอลลาเจนภายนอก อย่างไรก็ตาม อิมแพลนต์ดังกล่าวมีโมเลกุลคอลลาเจน 2 ประเภท คือ I และ II อิมแพลนต์จากเซลล์กระดูกอ่อนที่แยกความแตกต่างโดยผ่านชุดช่องจะมีไกลโคซามิโนไกลแคนและคอลลาเจนมากกว่าอิมแพลนต์จากเซลล์กระดูกอ่อนที่แยกความแตกต่างเป็นหลัก
L. Freed et al. (1993b) เปรียบเทียบพฤติกรรมของการเพาะเลี้ยงเซลล์กระดูกอ่อนของมนุษย์และโคในกรดโพลีไกลโคลิกที่มีเส้นใย (FPGA) และกรดโพลีแลกติกที่มีรูพรุน (PPLA) หลังจากเพาะเลี้ยงเซลล์กระดูกอ่อนของโคใน FPGA หรือ PPLA เป็นเวลา 6-8 สัปดาห์ ผู้เขียนสังเกตการแพร่กระจายของเซลล์และการสร้างใหม่ของเมทริกซ์กระดูกอ่อน ใน FPGA เซลล์กระดูกอ่อนมีรูปร่างเป็นทรงกลมและอยู่ในช่องว่างที่ล้อมรอบด้วยเมทริกซ์กระดูกอ่อน หลังจากเพาะเลี้ยงในหลอดทดลองเป็นเวลา 8 สัปดาห์ เนื้อเยื่อที่สร้างใหม่จะมีมวลแห้งสูงถึง 50% (มวลเซลล์ 4% ไกลโคซามิโนไกลแคน 15% และคอลลาเจน 31%) ใน PPLA เซลล์มีรูปร่างเป็นกระสวยและมีไกลโคซามิโนไกลแคนและคอลลาเจนในปริมาณเล็กน้อย ใน FPGA การเติบโตของเซลล์มีความเข้มข้นมากกว่าใน PPLA ถึง 2 เท่า ในร่างกาย เซลล์กระดูกอ่อนที่ปลูกใน VPGK และ PPLC สร้างเนื้อเยื่อที่มีโครงสร้างทางจุลกายวิภาคคล้ายกับกระดูกอ่อนภายใน 1-6 เดือน รากฟันเทียมประกอบด้วยไกลโคสะมิโนไกลแคน คอลลาเจนชนิด I และ II
เซลล์กระดูกอ่อนของโคได้รับการเพาะเลี้ยงในโพลีเอทิลีนชนิดไม่ชอบน้ำและไม่ชอบน้ำที่มีความหนาแน่นสูงที่มีรูพรุน หลังจากฟักในสารตั้งต้นทั้งสองชนิดเป็นเวลา 7 วัน เซลล์ยังคงมีรูปร่างเป็นทรงกลมและมีคอลลาเจนชนิดที่ 2 เป็นหลัก หลังจากเพาะเลี้ยงเป็นเวลา 21 วัน พบว่าเมทริกซ์ที่ชอบน้ำมีคอลลาเจนชนิดที่ 2 มากกว่าเมทริกซ์ที่ชอบน้ำ
เนื้อเยื่อกระดูกอ่อนสามารถได้มาจากการเพาะเลี้ยงในชั้นเดียวบนแผ่นกรอง Millicell-CM จำเป็นต้องเคลือบแผ่นกรองด้วยคอลลาเจนก่อนเพื่อให้คอนดรอยตินเกาะติด การตรวจสอบทางจุลพยาธิวิทยาของการเพาะเลี้ยงแสดงให้เห็นการสะสมของคอนโดรไซต์ใน ECM ที่มีโปรตีโอกลีแคนและคอลลาเจนประเภท II ไม่พบคอลลาเจนประเภท I ในการเพาะเลี้ยงดังกล่าว คอนโดรไซต์ในเนื้อเยื่อกระดูกอ่อนที่ได้มีรูปร่างเป็นทรงกลม แต่บนพื้นผิวของเนื้อเยื่อจะค่อนข้างแบน ความหนาของเนื้อเยื่อที่เพิ่งสร้างใหม่จะเพิ่มขึ้นตามเวลาและขึ้นอยู่กับความหนาแน่นเริ่มต้นของชั้นเดียวของเซลล์ ภายใต้สภาวะการเพาะเลี้ยงที่เหมาะสม ความหนาของเนื้อเยื่อกระดูกอ่อนจะถึง 110 ไมโครเมตร การจัดระเบียบของเซลล์และคอลลาเจนในชั้นผิวเผินและชั้นลึกจะคล้ายกับกระดูกอ่อนข้อต่อ ECM มีคอลลาเจนและโปรตีโอกลีแคนมากกว่าประมาณ 3 เท่า หลังจากเพาะเลี้ยง 2 สัปดาห์ พบว่ามีการสะสมของเมทริกซ์ ทำให้สามารถสกัดเนื้อเยื่อออกจากแผ่นกรองและนำไปใช้สำหรับการปลูกถ่ายได้
Sims et al. (1996) ศึกษาการเพาะเลี้ยงเซลล์กระดูกอ่อนในเจลโพลีเอทิลีนออกไซด์ ซึ่งเป็นเมทริกซ์โพลิเมอร์แบบห่อหุ้มที่ช่วยให้สามารถถ่ายโอนเซลล์จำนวนมากได้โดยการฉีด หกสัปดาห์หลังจากการฉีดเข้าไปในเนื้อเยื่อใต้ผิวหนังของหนูที่ไม่มีไธมัส กระดูกอ่อนใหม่จะก่อตัวขึ้น ซึ่งมีลักษณะทางสัณฐานวิทยาคือมีสีขาวขุ่นคล้ายกับกระดูกอ่อนใส ข้อมูลทางเนื้อเยื่อวิทยาและชีวเคมีบ่งชี้ว่ามีเซลล์กระดูกอ่อนที่แบ่งตัวอย่างรวดเร็วและผลิต ECM
การอธิบาย
การปลูกถ่ายเนื้อเยื่อกระดูกอ่อนใช้เพื่อศึกษาขั้นตอนการสร้างและสลายตัวในเนื้อเยื่อ การรักษาภาวะธำรงดุล การดูดซึม และการซ่อมแซม เซลล์กระดูกอ่อนในเนื้อเยื่อกระดูกอ่อนที่ปลูกถ่ายจะรักษาฟีโนไทป์ปกติและองค์ประกอบ ECM ที่คล้ายคลึงกับของกระดูกอ่อนข้อในร่างกาย หลังจากเพาะเลี้ยงเป็นเวลา 5 วันในซีรั่ม ก็จะได้กระบวนการสังเคราะห์และย่อยสลายตามธรรมชาติที่คงที่ การดูดซึมของเนื้อเยื่อสามารถเร่งขึ้นได้ในวัฒนธรรมหลักและในวัฒนธรรมด้วยการเติมซีรั่มโดยใช้สารหลายชนิด เช่น IL-IB, TNF-α, ไลโปโพลีแซ็กคาไรด์ของแบคทีเรีย, อนุพันธ์ของกรดเรตินอยด์ หรืออนุมูลอิสระออกซิเจนที่มีฤทธิ์ เพื่อศึกษาการซ่อมแซมกระดูกอ่อน ความเสียหายของกระดูกอ่อนจะถูกเหนี่ยวนำโดยตัวกลางการอักเสบที่ละลายน้ำได้ (H 2 O 2, IL-1, TNF-α) หรือการแตกของเมทริกซ์ทางกายภาพ
วิธีการเพาะเลี้ยงเนื้อเยื่อกระดูกอ่อนเป็นแบบจำลองสำหรับการศึกษาในหลอดทดลองเกี่ยวกับผลกระทบของปัจจัยภายนอกที่แยกออกมาต่อเซลล์กระดูกอ่อนและเมทริกซ์โดยรอบ ในร่างกาย เซลล์กระดูกอ่อนจะอยู่ใน ECM เพียงเล็กน้อยและไม่สัมผัสกัน การเพาะเลี้ยงเนื้อเยื่อกระดูกอ่อนจากข้อต่อช่วยรักษาโครงสร้างนี้ไว้ รวมถึงปฏิสัมพันธ์เฉพาะระหว่างเซลล์กระดูกอ่อนและสภาพแวดล้อมภายนอกโดยรอบ แบบจำลองนี้ยังใช้เพื่อศึกษาผลกระทบของความเครียดทางกล ตัวแทนทางเภสัชวิทยา ปัจจัยการเจริญเติบโต ไซโตไคน์ และฮอร์โมนต่อการเผาผลาญของกระดูกอ่อนอีกด้วย
ข้อดีอีกประการของการปลูกถ่ายเนื้อเยื่อกระดูกอ่อนคือเซลล์กระดูกอ่อนจะไม่ได้รับความเสียหายจากการกระทำของเอนไซม์โปรตีโอไลติกหรือปัจจัยทางกล ซึ่งหลีกเลี่ยงไม่ได้เมื่อแยกเซลล์ ตัวรับและโปรตีนเยื่อหุ้มเซลล์และไกลโคโปรตีนอื่นๆ ได้รับการปกป้องจากปัจจัยที่ก่อให้เกิดความเสียหาย
 [ 17 ], [ 18 ], [ 19 ], [ 20 ], [ 21 ]
[ 17 ], [ 18 ], [ 19 ], [ 20 ], [ 21 ]
การเพาะเลี้ยงกระดูกอ่อน
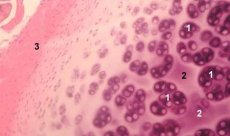
คอนดรอนเป็นหน่วยโครงสร้าง หน้าที่ และการเผาผลาญของกระดูกอ่อนข้อต่อ ประกอบด้วยคอนโดรไซต์ เมทริกซ์รอบเซลล์ และแคปซูลเส้นใยที่แน่นหนา และมีหน้าที่รักษาสมดุลของเมทริกซ์ คอนดรอนถูกสกัดออกจากกระดูกอ่อนด้วยกลไกและรวบรวมโดยใช้กระบวนการทำให้เป็นเนื้อเดียวกันด้วยความเร็วต่ำหลายๆ ครั้งติดต่อกัน คอนดรอนที่แยกจากโซนที่มีความลึกของกระดูกอ่อนต่างกันสามารถแบ่งได้เป็น 4 ประเภท ได้แก่ คอนโดรนดรอนเดี่ยว คอนโดรนดรอนคู่ คอนโดรนดรอนที่จัดเรียงเป็นเส้นตรงหลายอัน (สามอันขึ้นไป) (คอลัมน์คอนโดรนดรอน) และกลุ่มคอนโดรนดรอน
โดยทั่วไปจะพบคอนดรอนเดี่ยวในชั้นกลางของกระดูกอ่อนที่ยังไม่บุบสลาย คอนดรอนคู่จะพบที่ขอบของชั้นกลางและชั้นลึก คอนดรอนหลายอันที่เรียงเป็นเส้นตรงเป็นลักษณะเฉพาะของชั้นลึกของกระดูกอ่อนที่ยังไม่บุบสลาย ในที่สุด คลัสเตอร์คอนดรอนประกอบด้วยกลุ่มคอนดรอนเดี่ยวและคู่ที่จัดเรียงแบบสุ่ม ซึ่งคงสถานะรวมกันหลังจากการทำให้เป็นเนื้อเดียวกัน คลัสเตอร์คอนดรอนเป็นชิ้นส่วนขนาดใหญ่ของกระดูกอ่อน โดยปกติจะมีคอนดรอนหลายอันและเส้นใยคอลลาเจนที่เรียงตัวในแนวรัศมี ซึ่งเป็นลักษณะการจัดระเบียบทั่วไปของชั้นลึกของเมทริกซ์ คอนดรอนถูกตรึงในอะกาโรสโปร่งใส ซึ่งช่วยให้สามารถศึกษาโครงสร้าง องค์ประกอบโมเลกุล และกิจกรรมการเผาผลาญได้ ระบบคอนดรอน-อะกาโรสถือเป็นไมโครโมเดลของกระดูกอ่อน ซึ่งแตกต่างจากระบบคอนโดรไซต์-อะกาโรสแบบดั้งเดิม ตรงที่รักษาไมโครเอ็นไวรอนเมนต์ตามธรรมชาติไว้ และไม่จำเป็นต้องสังเคราะห์และประกอบขึ้น การเพาะเลี้ยงกระดูกอ่อนเป็นแบบจำลองสำหรับการศึกษาปฏิสัมพันธ์ระหว่างเซลล์และเมทริกซ์ในกระดูกอ่อนข้อภายใต้สภาวะปกติและสภาวะทางพยาธิวิทยา
 [ 22 ], [ 23 ], [ 24 ], [ 25 ], [ 26 ], [ 27 ]
[ 22 ], [ 23 ], [ 24 ], [ 25 ], [ 26 ], [ 27 ]
การเพาะเลี้ยงเซลล์กระดูกอ่อนอมตะ
ไวรัสที่ประกอบด้วยยีนก่อมะเร็งหรือดีเอ็นเอรีคอมบิแนนท์ที่สามารถทำให้เซลล์เป็น "อมตะ" ถูกนำมาใช้เพื่อสร้างสายเซลล์ถาวร เซลล์กระดูกอ่อนที่เป็นอมตะมีความสามารถในการขยายพันธุ์อย่างไม่มีที่สิ้นสุดในขณะที่ยังคงรักษาลักษณะที่เสถียรไว้ได้ F. Mallein-Gerin et al. (1995) แสดงให้เห็นว่ายีนก่อมะเร็ง SV40T กระตุ้นให้เซลล์กระดูกอ่อนของหนูขยายพันธุ์ ซึ่งยังคงแสดงคอลลาเจนประเภท II, IX และ XI อย่างเสถียร รวมถึงแอกกรีแคนที่ข้อต่อและโปรตีนจับ อย่างไรก็ตาม สายเซลล์ดังกล่าวจะได้รับความสามารถในการสังเคราะห์คอลลาเจนประเภท I เมื่อเพาะเลี้ยงในวัฒนธรรมโมโนเลเยอร์หรือในเจลอะกาโรส
W. Horton และคณะ (1988) บรรยายถึงเซลล์อมตะสายพันธุ์หนึ่งที่มีการแสดงออกของ mRNA ของคอลลาเจนชนิดที่ 2 ในระดับต่ำ เซลล์เหล่านี้ได้มาจากการแปรรูปด้วยไวรัสเรโทรของหนูที่มียีนออนโคยีน I-myc และ y-ra เซลล์ประเภทนี้ถือเป็นแบบจำลองเฉพาะสำหรับการศึกษาปฏิสัมพันธ์ของเมทริกซ์ข้อต่อในกรณีที่ไม่มีคอลลาเจนชนิดที่ 2 รวมถึงการควบคุมการสังเคราะห์คอลลาเจนชนิดที่ 2
การเพาะเลี้ยงคอนโดรไพรต์ที่มียีนที่กลายพันธุ์หรือถูกลบออกนั้นเป็นแบบจำลองที่สะดวกสำหรับการศึกษาหน้าที่ทางสรีรวิทยาของคอนโดรไพรต์ แบบจำลองนี้เหมาะเป็นพิเศษสำหรับการศึกษาบทบาทของโมเลกุลเฉพาะในการจัดระเบียบเมทริกซ์ของกระดูกอ่อนหรือสำหรับการตรวจสอบผลกระทบของปัจจัยควบคุมต่างๆ ต่อการเผาผลาญของกระดูกอ่อน เซลล์คอนโดรไซต์ที่มียีนที่ถูกลบออกสำหรับคอลลาเจนชนิด IX จะสังเคราะห์เส้นใยคอลลาเจนที่มีขนาดกว้างกว่าปกติ ซึ่งบ่งชี้ว่าคอลลาเจนชนิด IX ควบคุมเส้นผ่านศูนย์กลางของเส้นใย ดังที่กล่าวไว้ในบทที่ 1 การกลายพันธุ์ในยีน COLAI ที่เข้ารหัสคอลลาเจนชนิด II ถูกค้นพบเมื่อไม่นานนี้ในครอบครัวที่มีโรคข้อเสื่อมทั่วไปแบบปฐมภูมิ เพื่อศึกษาผลกระทบของคอลลาเจนชนิด II ที่กลายพันธุ์ต่อเมทริกซ์ของข้อต่อ R. Dharmrvaram et al. (1997) ได้ถ่ายโอน COL 2 AI ที่มีข้อบกพร่อง (ติดเชื้อด้วยกรดนิวคลีอิกแปลกปลอม) (อาร์จินีนที่ตำแหน่ง 519 ถูกแทนที่ด้วยซิสเตอีน) เข้าไปในเซลล์คอนโดรไซต์ของทารกในครรภ์มนุษย์ในหลอดทดลอง
ระบบการเพาะเลี้ยงร่วมกัน ในข้อต่อ กระดูกอ่อนจะโต้ตอบกับเซลล์ประเภทอื่นที่มีอยู่ในเยื่อหุ้มข้อ ของเหลวในข้อ เส้นเอ็น และกระดูกใต้กระดูกอ่อน การเผาผลาญของเซลล์กระดูกอ่อนอาจได้รับผลกระทบจากปัจจัยที่ละลายน้ำได้ต่างๆ ที่สังเคราะห์ขึ้นโดยเซลล์ที่ระบุไว้ ดังนั้น ในโรคข้ออักเสบ กระดูกอ่อนในข้อจะถูกทำลายโดยเอนไซม์โปรตีโอไลติกและอนุมูลอิสระที่ผลิตโดยเซลล์ในข้อ ดังนั้น จึงได้มีการพัฒนารูปแบบเพื่อศึกษาปฏิสัมพันธ์ที่ซับซ้อนระหว่างกระดูกอ่อนและเนื้อเยื่อโดยรอบ ซึ่งเรียกว่าการเพาะเลี้ยงร่วมกัน
S. Lacombe-Gleise และคณะ (1995) เพาะเลี้ยงเซลล์กระดูกอ่อนและเซลล์สร้างกระดูกของกระต่ายในระบบการเพาะเลี้ยงร่วมกัน (COSTAR) ซึ่งเซลล์ถูกแยกออกจากกันด้วยเยื่อพรุนขนาดเล็ก (0.4 ไมโครเมตร) ซึ่งช่วยให้เซลล์ทั้งสองประเภทสามารถแลกเปลี่ยนกันได้โดยไม่ต้องสัมผัสกันโดยตรง การศึกษาครั้งนี้แสดงให้เห็นถึงความสามารถของเซลล์สร้างกระดูกในการกระตุ้นการเจริญเติบโตของเซลล์กระดูกอ่อนผ่านตัวกลางที่ละลายน้ำได้
AM Malfait และผู้เขียนร่วม (1994) ศึกษาความสัมพันธ์ระหว่างโมโนไซต์ของเลือดส่วนปลายและคอนโดรไซต์ แบบจำลองนี้สะดวกสำหรับการศึกษาขั้นตอนที่เกี่ยวข้องกับไซโตไคน์ในโรคข้ออักเสบ (โรคไขข้ออักเสบ โรคข้อเสื่อมจากสปอนดิโลอาร์ทริไทด์ที่เซโรเนกาทีฟ เป็นต้น) ผู้เขียนแบบจำลองแยกเซลล์ด้วยเยื่อยึดโปรตีนที่มีรูพรุนขนาดเส้นผ่านศูนย์กลาง 0.4 ไมโครเมตร การศึกษาแสดงให้เห็นว่าโมโนไซต์ที่ได้รับการกระตุ้นด้วยไลโปโพลีแซ็กคาไรด์จะผลิต IL-1 และ TNF-α ซึ่งจะยับยั้งการสังเคราะห์แอกกรีแคนโดยคอนโดรไซต์และมีส่วนทำให้แอกกรีแคนที่สังเคราะห์แล้วสลายตัว
K. Tada และคณะ (1994) ได้สร้างแบบจำลองการเพาะเลี้ยงร่วมกันโดยวางเซลล์เยื่อบุผนังหลอดเลือดในเจลคอลลาเจน (ชนิด I) ไว้ในห้องด้านในที่แยกออกจากห้องด้านนอก โดยมีเซลล์กระดูกอ่อนวางอยู่ภายในโดยอาศัยตัวกรองที่มีขนาดรูพรุน 0.4 ไมโครเมตร ในสภาวะที่แยกออกจากห้องด้านนอกอย่างสมบูรณ์ เซลล์เยื่อบุผนังหลอดเลือดของมนุษย์จะสร้างท่อในเจลคอลลาเจนในสภาพที่มี EGF หรือ TGF-a เมื่อเพาะเลี้ยงเซลล์ทั้งสองประเภทพร้อมกัน การสร้างท่อที่ขึ้นอยู่กับ TGF-a โดยเซลล์เยื่อบุผนังหลอดเลือดจะถูกยับยั้ง การยับยั้งกระบวนการนี้โดยเซลล์กระดูกอ่อนจะถูกกำจัดบางส่วนโดยแอนติบอดีต่อ TGF-beta อาจสันนิษฐานได้ว่า TGF-beta ที่ผลิตโดยเซลล์กระดูกอ่อนจะยับยั้งการสร้างหลอดเลือดของกระดูกอ่อนเอง
S. Groot et al. (1994) เพาะเลี้ยงเซลล์กระดูกอ่อนจากบริเวณที่มีการเจริญเติบโตมากเกินไปและมีการเจริญของกระดูกของทารกในครรภ์หนูอายุ 16 วันพร้อมกับชิ้นส่วนของเนื้อสมอง หลังจากเพาะเลี้ยงเป็นเวลา 4 วัน เซลล์กระดูกอ่อนเกิดการเปลี่ยนสภาพเป็นเซลล์สร้างกระดูกและเริ่มมีการสร้างเซลล์สร้างกระดูกใหม่ หลังจากเพาะเลี้ยงเป็นเวลา 11 วัน กระดูกอ่อนบางส่วนถูกแทนที่ด้วยเนื้อเยื่อกระดูกและเมทริกซ์ของกระดูกมีแคลเซียมเกาะบางส่วน เปปไทด์ประสาทและสารสื่อประสาทบางชนิดที่ผลิตโดยเนื้อเยื่อสมองมีผลต่อการเผาผลาญของเซลล์สร้างกระดูกหรือมีตัวรับสำหรับเซลล์เหล่านี้ ได้แก่ นอร์เอพิเนฟริน เปปไทด์ลำไส้ที่มีฤทธิ์ต่อหลอดเลือด เปปไทด์ที่เกี่ยวข้องกับยีนแคลซิโทนิน สาร P และโซมาโทสแตติน ชิ้นส่วนของเนื้อสมองที่เพาะเลี้ยงร่วมกับเซลล์กระดูกอ่อนสามารถผลิตปัจจัยที่ระบุไว้บางส่วนที่สามารถกระตุ้นกระบวนการเปลี่ยนสภาพของเซลล์กระดูกอ่อนเป็นเซลล์สร้างกระดูกได้
 [ 28 ], [ 29 ], [ 30 ], [ 31 ], [ 32 ], [ 33 ]
[ 28 ], [ 29 ], [ 30 ], [ 31 ], [ 32 ], [ 33 ]
อิทธิพลของปัจจัยภายนอกต่อการเพาะเลี้ยงเซลล์กระดูกอ่อน
อิทธิพลของความตึงของออกซิเจนต่อการเผาผลาญของเซลล์กระดูกอ่อน
ในกรณีส่วนใหญ่ การเพาะเลี้ยงเซลล์กระดูกอ่อนจะพัฒนาขึ้นภายใต้สภาวะที่มีออกซิเจนในบรรยากาศ อย่างไรก็ตาม เป็นที่ทราบกันดีว่าเซลล์กระดูกอ่อนในร่างกายจะดำรงอยู่ภายใต้สภาวะที่ขาดออกซิเจน และออกซิเจนจะแตกต่างกันไปภายใต้สภาวะทางพยาธิวิทยาต่างๆ ในระหว่างกระบวนการเจริญเติบโต จะสังเกตเห็นการเปลี่ยนแปลงที่สำคัญในการไหลเวียนของเลือดไปยังเอพิฟิซิส เนื่องจากการสร้างหลอดเลือดแตกต่างกันไปในโซนต่างๆ ของแผ่นการเจริญเติบโต ออกซิเจนจึงแตกต่างกันไปด้วย C. Brighton และ R. Heppenstall (1971) แสดงให้เห็นว่าในแผ่นกระดูกแข้งของกระต่าย ออกซิเจนในบริเวณไฮเปอร์โทรฟิกจะต่ำกว่าในกระดูกอ่อนโดยรอบ การวัดพารามิเตอร์การเผาผลาญบางอย่างแสดงให้เห็นว่าเซลล์กระดูกอ่อนสามารถตอบสนองได้อย่างรวดเร็วต่อการเปลี่ยนแปลงความเข้มข้นของออกซิเจนในพื้นที่ ประการแรก เมื่อออกซิเจนมีความเข้มข้นต่ำ การบริโภคออกซิเจนโดยเซลล์กระดูกอ่อนจะลดลง เมื่อออกซิเจนมีความเข้มข้นลดลงจาก 21% เป็น 0.04% การใช้กลูโคสจะเพิ่มขึ้น กิจกรรมของเอนไซม์ไกลโคไลติกและการสังเคราะห์กรดแลกติกจะเพิ่มขึ้น แม้ว่าความตึงเครียดของออกซิเจนจะต่ำ แต่ปริมาณ ATP, ADP และ AMP ที่แน่นอนยังคงเสถียร ข้อมูลเหล่านี้บ่งชี้ว่าการเผาผลาญของเซลล์กระดูกอ่อนมีเป้าหมายเพื่อการอนุรักษ์พลังงานสูงสุด อย่างไรก็ตาม กิจกรรมการสังเคราะห์ และกระบวนการซ่อมแซมจะเปลี่ยนแปลงไปภายใต้สภาวะที่ขาดออกซิเจน
แรงตึงของออกซิเจนที่สูงยังส่งผลต่อการเผาผลาญของเซลล์กระดูกอ่อน ทำให้โปรตีโอไกลแคนและการสังเคราะห์ DNA ลดลง และเมทริกซ์ของกระดูกอ่อนก็เสื่อมสลาย ผลกระทบเหล่านี้มักเกิดขึ้นพร้อมกับการสร้างอนุมูลอิสระของออกซิเจน
อิทธิพลของความเข้มข้นของไอออนและความดันออสโมซิสของสิ่งแวดล้อมต่อการทำงานของเซลล์กระดูกอ่อน
ในกระดูกอ่อนตามธรรมชาติ ความเข้มข้นของไอออนจะแตกต่างอย่างมากจากในเนื้อเยื่ออื่นๆ โดยปริมาณโซเดียมในอาหารเลี้ยงเซลล์ภายนอกอยู่ที่ 250-350 มิลลิโมล และความเข้มข้นของออสโมลาริตี้อยู่ที่ 350-450 โมล เมื่อแยกเซลล์กระดูกอ่อนออกจาก ECM และฟักในอาหารเลี้ยงเซลล์มาตรฐาน (DMEM (Dulbecco's Minimal Essential Medium) ความเข้มข้นของออสโมลาริตี้อยู่ที่ 250-280.7 โมล) สภาพแวดล้อมโดยรอบเซลล์จะเปลี่ยนแปลงไปอย่างมาก นอกจากนี้ ความเข้มข้นของแคลเซียมและโพแทสเซียมในอาหารเลี้ยงเซลล์มาตรฐานจะต่ำกว่าในเนื้อเยื่อตามธรรมชาติอย่างมาก และความเข้มข้นของแอนไอออนจะสูงกว่าอย่างมีนัยสำคัญ
การเติมซูโครสลงในอาหารเลี้ยงเชื้อจะเพิ่มความเข้มข้นของออสโมลาริตีและทำให้ความเข้มข้นของไอออน H +และแคลเซียมในไซโทซอลเพิ่มขึ้นชั่วคราวภายในเซลล์ การเปลี่ยนแปลงภายในเซลล์ดังกล่าวอาจส่งผลต่อกระบวนการสร้างกระดูกอ่อนและกิจกรรมการเผาผลาญอาหาร J. Urban et al. (1993) พบว่าการผสม35 8-ซัลเฟตและ3 - H-โพรลีนโดยเซลล์กระดูกอ่อนที่แยกออกมาซึ่งฟักใน DMEM มาตรฐานเป็นเวลา 2-4 ชั่วโมงนั้นมีเพียง 10% ของการผสมในเนื้อเยื่อปกติ ความเข้มข้นของการสังเคราะห์จะถึงจุดสูงสุดที่ความเข้มข้นของออสโมลาริตีของอาหารเลี้ยงเชื้อนอกเซลล์ที่ 350-400 มอสโมลทั้งในเซลล์กระดูกอ่อนที่แยกออกมาใหม่และในชิ้นส่วนเนื้อเยื่อกระดูกอ่อน นอกจากนี้ ปริมาตรของเซลล์กระดูกอ่อนยังเพิ่มขึ้น 30-40% หลังจากวางเซลล์ที่แยกออกมาใน DMEM มาตรฐานที่มีความเข้มข้นของออสโมลาริตีที่กำหนด อย่างไรก็ตาม เมื่อเพาะเลี้ยงเซลล์กระดูกอ่อนภายใต้สภาวะออสโมลาร์ที่ไม่เป็นไปตามธรรมชาติเป็นเวลา 12-16 ชั่วโมง เซลล์จะปรับตัวเข้ากับสภาวะใหม่ โดยลดความเข้มข้นของการสังเคราะห์ทางชีวภาพลงตามการเปลี่ยนแปลงของออสโมลาร์ของสภาพแวดล้อมนอกเซลล์
P. Borgetti et al. (1995) ศึกษาผลของความเข้มข้นของออสโมลาริตี้ของอาหารเลี้ยงเชื้อนอกเซลล์ต่อการเจริญเติบโต สัณฐานวิทยา และการสังเคราะห์ชีวภาพของเซลล์กระดูกอ่อนของหมู ผู้เขียนได้แสดงให้เห็นลักษณะทางชีวเคมีและสัณฐานวิทยาที่คล้ายกันของเซลล์กระดูกอ่อนที่เพาะเลี้ยงในอาหารเลี้ยงเชื้อที่มีความเข้มข้นของออสโมลาริตี้ 0.28 และ 0.38 มอสโมล เมื่อความเข้มข้นของออสโมลาริตี้ปานกลาง 0.48 มอสโมล พบว่าการแพร่กระจายของเซลล์และการสังเคราะห์โปรตีนลดลงในช่วง 4-6 ชั่วโมงแรกของการเพาะเลี้ยง แต่พารามิเตอร์เหล่านี้กลับคืนมาในภายหลังและในที่สุดก็ถึงค่าควบคุม เมื่อเพาะเลี้ยงเซลล์กระดูกอ่อนในอาหารเลี้ยงเชื้อที่มีความเข้มข้นของออสโมลาริตี้ 0.58 มอสโมล เซลล์จะสูญเสียความสามารถในการรักษาความเข้มข้นทางสรีรวิทยาของกระบวนการแพร่กระจาย และหลังจาก 6 วัน จำนวนเซลล์กระดูกอ่อนจะลดลงอย่างมีนัยสำคัญ เมื่อความเข้มข้นของออสโมลาริตี้ปานกลาง 0.58 มอสโมล พบว่าการสังเคราะห์โปรตีนถูกยับยั้งอย่างมาก นอกจากนี้ เมื่อเพาะเลี้ยงในอาหารที่มีความเข้มข้นของออสโมลาร์ 0.28-0.38 mOsm คอนโดรไซต์จะยังคงลักษณะทางสรีรวิทยาเอาไว้ เมื่อความเข้มข้นของออสโมลาร์สูงขึ้น (0.48-0.58 mOsm) จะเกิดการเปลี่ยนแปลงที่สำคัญในสัณฐานวิทยาของเซลล์ ซึ่งแสดงให้เห็นได้จากการสูญเสียลักษณะทางสรีรวิทยา การเปลี่ยนแปลงคอนโดรไซต์เป็นเซลล์คล้ายไฟโบรบลาสต์ และการสูญเสียความสามารถของเซลล์ในการสร้างโปรตีโอกลีแคนเมทริกซ์ ผลการศึกษาครั้งนี้บ่งชี้ถึงความสามารถของคอนโดรไซต์ในการตอบสนองต่อความผันผวนที่จำกัดของความเข้มข้นของออสโมลาร์ในสภาพแวดล้อมนอกเซลล์
การเปลี่ยนแปลงความเข้มข้นของไอออนอื่นๆ อาจส่งผลต่อกระบวนการสังเคราะห์ทางชีวภาพในคอนโดรไซต์ได้เช่นกัน ดังนั้น ระดับการรวมตัวของ35 S (ซัลเฟต) จะเพิ่มขึ้นครึ่งหนึ่งเมื่อความเข้มข้นของไอออนโพแทสเซียมเพิ่มขึ้นจาก 5 มิลลิโมล (ความเข้มข้นในอาหารเลี้ยงเชื้อ DM EM มาตรฐาน) เป็น 10 มิลลิโมล (ความเข้มข้นใน ECM ในร่างกาย) ความเข้มข้นของแคลเซียมต่ำกว่า 0.5 มิลลิโมลส่งเสริมการผลิตคอลลาเจนโดยคอนโดรไซต์ของวัวที่โตเต็มที่ ในขณะที่ความเข้มข้น 1-2 มิลลิโมล (สอดคล้องกับความเข้มข้นในอาหารเลี้ยงเชื้อ DM EM มาตรฐาน) ทำให้การสังเคราะห์คอลลาเจนลดลงอย่างมีนัยสำคัญ พบว่าการสังเคราะห์ทางชีวภาพเพิ่มขึ้นในระดับปานกลางที่ระดับแคลเซียมสูง (2-10 มิลลิโมล) ไอออนบวกต่างๆ มีส่วนร่วมในการจับคอนโดรไซต์กับโปรตีน ECM ดังนั้น ไอออนแมกนีเซียมและแมงกานีสจึงทำหน้าที่จับกับไฟโบนิคตินและคอลลาเจนชนิดที่ 2 ในขณะที่ไอออนแคลเซียมไม่มีส่วนร่วมในการจับคอนโดรไซต์กับโปรตีน ดังนั้นผลการศึกษาที่ได้ดังกล่าวบ่งชี้ถึงอิทธิพลของการเปลี่ยนแปลงของไอออนนอกเซลล์ของโพแทสเซียม โซเดียม แคลเซียม และความเข้มข้นของออสโมลาริตี้ของตัวกลางต่อฟังก์ชันการสังเคราะห์ของเซลล์กระดูกอ่อนที่เพาะในอาหารมาตรฐาน
ผลของความเครียดทางกลต่อการเผาผลาญของเซลล์กระดูกอ่อน
ข้อต่อที่เคลื่อนไหวไม่ได้ทำให้กระดูกอ่อนฝ่อลงได้ ซึ่งบ่งชี้ถึงความจำเป็นของการกระตุ้นทางกลเพื่อให้กระบวนการเผาผลาญปกติใน ECM ในกรณีส่วนใหญ่ โมเดลการเพาะเลี้ยงเซลล์ที่ใช้จะมีอยู่ภายใต้ความดันบรรยากาศปกติ M. Wright et al. (1996) แสดงให้เห็นว่าสภาพแวดล้อมทางกลส่งผลต่อการเผาผลาญของเซลล์กระดูกอ่อน การตอบสนองของเซลล์ขึ้นอยู่กับความเข้มข้นและความถี่ของแรงกด การทดลองกับแรงกดบนชิ้นส่วนกระดูกอ่อนข้อต่อที่ยังไม่เสียหายในหลอดทดลองแสดงให้เห็นว่าการสังเคราะห์โปรตีนและโปรตีโอกลีแคนลดลงภายใต้การกระทำของแรงกดแบบคงที่ ในขณะที่แรงกดแบบไดนามิกกระตุ้นกระบวนการเหล่านี้ กลไกที่แน่นอนของผลของแรงกดบนกระดูกอ่อนมีความซับซ้อนและอาจเกี่ยวข้องกับการเสียรูปของเซลล์ แรงดันไฮโดรสแตติก แรงดันออสโมซิส ศักย์ไฟฟ้า และตัวรับเซลล์บนพื้นผิวสำหรับโมเลกุลเมทริกซ์ เพื่อศึกษาผลของพารามิเตอร์เหล่านี้แต่ละตัว จำเป็นต้องสร้างระบบที่สามารถเปลี่ยนพารามิเตอร์หนึ่งได้อย่างอิสระ ตัวอย่างเช่น การเพาะเลี้ยงเซลล์จากส่วนต่างๆ ไม่เหมาะสำหรับการศึกษาการเสียรูปของเซลล์ แต่สามารถใช้ศึกษาผลกระทบโดยทั่วไปของแรงกดดันต่อกิจกรรมการเผาผลาญของเซลล์กระดูกอ่อนได้ การบีบอัดของกระดูกอ่อนทำให้เซลล์เสียรูป และยังมาพร้อมกับการเกิดขึ้นของการไล่ระดับความดันไฮโดรสแตติก ศักย์ไฟฟ้า การไหลของของเหลว และการเปลี่ยนแปลงในพารามิเตอร์ทางฟิสิกเคมี เช่น ปริมาณน้ำในเมทริกซ์ ความหนาแน่นของประจุไฟฟ้า และระดับความดันออสโมซิส สามารถศึกษาการเสียรูปของเซลล์ได้โดยใช้เซลล์กระดูกอ่อนที่แยกออกมาแช่ในอะกาโรสหรือเจลคอลลาเจน
ระบบต่างๆ ได้รับการพัฒนาขึ้นเพื่อศึกษาผลของการกระตุ้นทางกลต่อการเพาะเลี้ยงเซลล์กระดูกอ่อน นักวิจัยบางคนใช้ระบบที่ใช้แรงดันในการเพาะเลี้ยงเซลล์ผ่านเฟสก๊าซ ดังนั้น JP Veldhuijzen et al. (1979) ที่ใช้แรงดัน 13 kPa เหนือบรรยากาศด้วยความถี่ต่ำ (0.3 Hz) เป็นเวลา 15 นาที พบว่าการสังเคราะห์ cAMP และโปรตีโอกลีแคนเพิ่มขึ้น และการสังเคราะห์ DNA ลดลง R. Smith et al. (1996) แสดงให้เห็นว่าการสัมผัสกับแรงดันไฮโดรสแตติก (10 MPa) เป็นระยะๆ ด้วยความถี่ 1 Hz เป็นเวลา 4 ชั่วโมงของเพาะเลี้ยงเซลล์กระดูกอ่อนของวัวทำให้การสังเคราะห์ aggrecan และคอลลาเจนชนิด II เพิ่มขึ้น ในขณะที่แรงดันคงที่ไม่ส่งผลต่อกระบวนการเหล่านี้ โดยใช้ระบบที่คล้ายกัน Wright et al. (1996) รายงานว่าแรงดันแบบวงจรต่อการเพาะเลี้ยงเซลล์สัมพันธ์กับการเกิดโพลาไรเซชันเกินของเยื่อหุ้มเซลล์คอนโดรไซต์และการกระตุ้นช่องโพแทสเซียมที่ขึ้นอยู่กับ Ca 2+ดังนั้น ผลกระทบของแรงดันแบบวงจรจึงถูกควบคุมโดยช่องไอออนที่กระตุ้นด้วยการยืดในเยื่อหุ้มเซลล์คอนโดรไซต์ การตอบสนองของคอนโดรไซต์ต่อแรงดันไฮโดรสแตติกขึ้นอยู่กับสภาวะการเพาะเลี้ยงเซลล์และความถี่ของภาระที่ใช้ ดังนั้น แรงดันไฮโดรสแตติกแบบวงจร (5 MPa) จะลดการรวมซัลเฟตเข้าไปในชั้นโมโนเลเยอร์ของคอนโดรไซต์ที่ความถี่ 0.05, 0.25 และ 0.5 Hz ในขณะที่ที่ความถี่มากกว่า 0.5 Hz การรวมซัลเฟตเข้าไปในชิ้นส่วนกระดูกอ่อนจะเพิ่มขึ้น
M. Bushmann และคณะ (1992) รายงานว่าเซลล์กระดูกอ่อนในเจลอะกาโรสจะเปลี่ยนแปลงกระบวนการสังเคราะห์ชีวภาพโดยตอบสนองต่อการรับน้ำหนักทางกลแบบสถิตและแบบไดนามิกในลักษณะเดียวกับอวัยวะที่เพาะเลี้ยงไว้โดยไม่บุบสลาย ผู้เขียนพบว่าการรับน้ำหนักทางกลจะก่อให้เกิดการกระตุ้นแบบไฮเปอร์ออสโมซิส ส่งผลให้ค่า pH ในเซลล์กระดูกอ่อนลดลงตามมา
สามารถศึกษาผลของการยืดด้วยกลไกได้จากการเพาะเลี้ยงเซลล์ที่แช่อยู่ในเจล แรงยืดสามารถสร้างขึ้นได้โดยใช้สุญญากาศที่ควบคุมด้วยคอมพิวเตอร์ เมื่อระบบอยู่ภายใต้สุญญากาศในระดับหนึ่ง ส่วนล่างของจานเพาะเชื้อที่มีการเพาะเลี้ยงเซลล์จะยืดออกในปริมาณที่ทราบ การเปลี่ยนรูปจะสูงสุดที่ขอบของส่วนล่างของจานและน้อยที่สุดที่กึ่งกลาง การยืดจะส่งต่อไปยังคอนโดรไซต์ที่เพาะเลี้ยงในจานเพาะเชื้อด้วย โดยใช้เทคนิคนี้ K. Holm-vall et al. (1995) แสดงให้เห็นว่าในเซลล์คอนโดรซาร์โคมาที่มีการเพาะเลี้ยงในเจลคอลลาเจน (ชนิด II) การแสดงออกของ mRNA ของ 2-อินทิกรินจะเพิ่มขึ้นอินทิกริน2 βสามารถจับกับคอลลาเจนชนิด II ได้ ถือเป็นตัวรับแรงกล เนื่องจากโต้ตอบกับโปรตีนที่จับแอคติน จึงเชื่อมต่อ ECM และไซโทสเกเลตันเข้าด้วยกัน
ผลของ pH ต่อการเผาผลาญของเซลล์กระดูกอ่อน
ค่า pH ของของเหลวในเนื้อเยื่อระหว่างกระดูกอ่อนของ ECM มีความเป็นกรดมากกว่าในเนื้อเยื่ออื่น A. Maroudas (1980) กำหนดค่า pH ของเมทริกซ์ของกระดูกอ่อนข้อที่ 6.9 B. Diamant et al. (1966) พบว่า pH อยู่ที่ 5.5 ในสภาวะทางพยาธิวิทยา เป็นที่ทราบกันดีว่าคอนโดรไซต์อาศัยอยู่ที่ PO2 ต่ำ ซึ่งบ่งชี้ถึงบทบาทสำคัญของไกลโคไลซิส (95% ของการเผาผลาญกลูโคสทั้งหมด) ในการเผาผลาญเซลล์เหล่านี้ ไกลโคไลซิสมาพร้อมกับการผลิตกรดแลกติกในปริมาณมาก
นอกเหนือจากการทำให้สิ่งแวดล้อมเป็นกรดโดยผลิตภัณฑ์ไกลโคไลซิสแล้ว ส่วนประกอบของเมทริกซ์เองก็มีความสำคัญมาก ประจุลบคงที่จำนวนมากในโปรตีโอกลีแคนจะปรับเปลี่ยนองค์ประกอบไอออนิกนอกเซลล์: สังเกตเห็นความเข้มข้นสูงของไอออนบวกอิสระ (เช่น H +, Na +, K + ) และความเข้มข้นต่ำของไอออนลบ (เช่น O2, HCO3 ) นอกจากนี้ ภายใต้อิทธิพลของการโหลดเชิงกล น้ำจะถูกขับออกจาก ECM ซึ่งนำไปสู่การเพิ่มขึ้นของความเข้มข้นของประจุลบคงที่และการดึงดูดไอออนบวกมากขึ้นเข้าสู่เมทริกซ์ สิ่งนี้มาพร้อมกับการลดลงของ pH ของสภาพแวดล้อมนอกเซลล์ซึ่งส่งผลต่อ pH ในเซลล์ จึงทำให้การเผาผลาญของเซลล์กระดูกอ่อนเปลี่ยนแปลงไป R. Wilkin และ A. Hall (1995) ศึกษาผลกระทบของ pH ของสภาพแวดล้อมนอกเซลล์และภายในเซลล์ต่อการสังเคราะห์เมทริกซ์โดยเซลล์กระดูกอ่อนของวัวที่แยกจากกัน พวกเขาสังเกตเห็นการปรับเปลี่ยนสองประการของการสังเคราะห์เมทริกซ์โดยการลดลงของ pH การลดลงเล็กน้อยของค่า pH (7.4
 [ 34 ], [ 35 ], [ 36 ], [ 37 ], [ 38 ], [ 39 ], [ 40 ]
[ 34 ], [ 35 ], [ 36 ], [ 37 ], [ 38 ], [ 39 ], [ 40 ]
อิทธิพลขององค์ประกอบของอาหารเลี้ยงเชื้อต่อการเผาผลาญของเซลล์กระดูกอ่อน
สื่อที่ใช้ในการเพาะเลี้ยงเซลล์กระดูกอ่อนจะต้องสอดคล้องกับเงื่อนไขการทดลอง ในช่วงไม่กี่ปีที่ผ่านมา มีการใช้เซรั่มลูกวัวเพื่อปรับเงื่อนไขการเพาะเลี้ยงให้เหมาะสมที่สุด อย่างไรก็ตาม เมื่อใช้เซรั่ม จะต้องคำนึงถึงประเด็นสำคัญหลายประการ ดังนี้
- การเจริญเติบโตของเซลล์ออกจากส่วนรอบนอกของเนื้อเยื่อในวัฒนธรรมอวัยวะ
- ความแปรปรวนในองค์ประกอบของเซรั่มแต่ละซีรีส์
- การมีอยู่ของส่วนประกอบที่ไม่รู้จักในนั้น
- ความเสี่ยงที่เพิ่มขึ้นของการรบกวนและสิ่งแปลกปลอมเมื่อศึกษาอิทธิพลของปัจจัยทางชีวภาพต่างๆ ต่อกิจกรรมการเผาผลาญของเซลล์
ตัวอย่างหลังคือการศึกษาผลของ EGF ต่อเซลล์กระดูกอ่อนในหนู EGF กระตุ้นให้เกิดการรวมตัวของ3H -thymidine และเพิ่มปริมาณ DNA ในวัฒนธรรม ผลกระทบนี้เด่นชัดมากขึ้นที่ความเข้มข้นในซีรั่มต่ำ (<1%) แต่ที่ความเข้มข้นสูง (>7.5%) ผลกระทบจะหายไป
เป็นที่ทราบกันดีว่าระดับการสังเคราะห์และการสลายตัวใน DMEM ที่เสริมด้วยเซรั่มลูกวัวนั้นเพิ่มขึ้นอย่างมีนัยสำคัญเมื่อเทียบกับสภาวะในร่างกาย ความแตกต่างระหว่างการเผาผลาญในร่างกายและในหลอดทดลองอาจเกิดจากความแตกต่างระหว่างของเหลวในข้อและอาหารที่เลี้ยงเซลล์ Lee et al. (1997) เลี้ยงเซลล์กระดูกอ่อนของโคในอะกาโรสโดยใช้อาหารเลี้ยงเชื้อที่มี DMEM เสริมด้วยเซรั่มลูกวัว 20% และของเหลวในข้อจากแม่ในปริมาณมาก การมีของเหลวในข้อในอาหารเลี้ยงเชื้อทำให้มีโปรตีโอกลีแคนเพิ่มขึ้น มากถึง 80% ของปริมาณของเหลวในข้อทั้งหมด ผลลัพธ์เหล่านี้บ่งชี้ว่าของเหลวในข้อในการเพาะเลี้ยงกระตุ้นให้เกิดการเผาผลาญในระดับที่ใกล้เคียงกับในร่างกาย โดยมีการสังเคราะห์ไกลโคสะมิโนกลีแคนในระดับสูงและมีการแบ่งเซลล์ในระดับต่ำ
G. Verbruggen et al. (1995) แสดงให้เห็นว่า การสังเคราะห์ S-arrpeKaHa จำนวน 35โดยเซลล์กระดูกอ่อนของมนุษย์ที่เพาะเลี้ยงในอะกาโรสใน DMEM ที่ไม่มีซีรั่มนั้นอยู่ที่ 20-30% ของระดับการสังเคราะห์ที่สังเกตได้ใน DMEM ที่เสริมด้วยซีรั่มลูกวัว 10% ผู้เขียนได้กำหนดระดับที่ IGF-1, IGF-2, TGF-R หรืออินซูลินฟื้นฟูการผลิตแอกกรีแคนในอาหารเลี้ยงเชื้อที่ไม่มีซีรั่ม ผู้เขียนสรุปได้ว่าอินซูลิน 100 นาโนกรัม/มล. IGF-1 หรือ IGF-2 ฟื้นฟูการสังเคราะห์แอกกรีแคนบางส่วนเป็น 39-53% ของระดับควบคุม ไม่พบการเสริมฤทธิ์หรือการสะสมร่วมกับปัจจัยที่ระบุไว้ร่วมกัน ในเวลาเดียวกัน TGF-R 10 นาโนกรัม/มล. ที่มีอินซูลิน 100 นาโนกรัม/มล. กระตุ้นการสังเคราะห์แอกกรีแคนเป็น 90% หรือมากกว่าของระดับอ้างอิง ในที่สุด ทรานสเฟอร์รินในซีรั่มของมนุษย์ ไม่ว่าจะใช้เพียงอย่างเดียวหรือร่วมกับอินซูลิน ก็ไม่มีผลต่อการสังเคราะห์แอกกรีแคน เมื่อซีรั่มลูกวัวถูกแทนที่ด้วยอัลบูมินในซีรั่มวัว ปริมาณสารรวมของแอกกรีแคนจะลดลงอย่างมีนัยสำคัญ การเพิ่มความเข้มข้นของอาหารเลี้ยงเชื้อด้วยอินซูลิน IGF หรือ TGF-R ช่วยฟื้นฟูความสามารถของเซลล์ในการผลิตสารรวมของแอกกรีแคนได้บางส่วน นอกจากนี้ IGF-1 และอินซูลินยังสามารถรักษาภาวะธำรงดุลภายในเซลล์เพาะเลี้ยงได้ หลังจากเพาะเลี้ยงเป็นเวลา 40 วันในอาหารเลี้ยงเชื้อที่เพิ่มความเข้มข้นของ IGF-1 10-20 นาโนกรัม/มิลลิลิตร การสังเคราะห์โปรตีโอไกลแคนจะคงอยู่ที่ระดับเดียวกันหรือสูงกว่าเมื่อเทียบกับอาหารเลี้ยงเชื้อที่มีซีรั่มลูกวัว 20% กระบวนการย่อยสลายดำเนินไปช้ากว่าในอาหารเลี้ยงเชื้อที่เพิ่มความเข้มข้นของ IGF-1 เมื่อเทียบกับในอาหารเลี้ยงเชื้อที่เพิ่มความเข้มข้นของอัลบูมิน 0.1% แต่ดำเนินไปเร็วกว่าเล็กน้อยในอาหารเลี้ยงเชื้อที่เพิ่มความเข้มข้นของซีรั่ม 20% ในอาหารเลี้ยงเชื้อที่มีอายุยืนยาว IGF-1 20 นาโนกรัม/มิลลิลิตรช่วยรักษาสถานะเซลล์ให้คงที่
D. Lee et al. (1993) เปรียบเทียบผลขององค์ประกอบของอาหารเลี้ยงเชื้อ (DMEM, DMEM+20% calf serum, DMEM+20 ng/ml IGF-1) ต่อการสังเคราะห์ DNA ในอาหารเลี้ยงเชื้อจากเนื้อเยื่อกระดูกอ่อน อาหารเลี้ยงเชื้อแบบโมโนเลเยอร์ และในสารแขวนลอยอะกาโรส เมื่อเพาะเลี้ยงในอะกาโรสโดยมีซีรั่มอยู่ด้วย ผู้เขียนสังเกตเห็นแนวโน้มที่คอนโดรไซต์จะรวมกลุ่มเป็นกลุ่มใหญ่ เซลล์ที่เพาะเลี้ยงโดยไม่มีซีรั่มหรือ IGF-1 จะยังคงมีรูปร่างกลมในอะกาโรส โดยรวบรวมเป็นกลุ่มเล็กๆ แต่ไม่ได้ก่อตัวเป็นกลุ่มใหญ่ ในโมโนเลเยอร์ การสังเคราะห์ DNA จะสูงขึ้นอย่างมีนัยสำคัญในอาหารเลี้ยงเชื้อที่มีซีรั่มเมื่อเทียบกับอาหารเลี้ยงเชื้อที่มี IGF-1 มากขึ้นอย่างมีนัยสำคัญ การสังเคราะห์ DNA ในอาหารเลี้ยงเชื้อแบบโมโนเลเยอร์จะสูงขึ้นอย่างมีนัยสำคัญเมื่อเทียบกับอาหารเลี้ยงเชื้อที่ไม่ได้เสริมด้วย IGF-1 ไม่พบความแตกต่างในการสังเคราะห์ DNA เมื่อเพาะเลี้ยงคอนโดรไซต์ในสารแขวนลอยอะกาโรสในอาหารเลี้ยงเชื้อที่ไม่ได้เสริมด้วย IGF-1 ในเวลาเดียวกัน การเพาะเลี้ยงเซลล์กระดูกอ่อนที่แขวนลอยอยู่ในอะกาโรสในอาหารเลี้ยงเชื้อที่มีซีรั่มเข้มข้นจะมาพร้อมกับการรวมตัวของเรดิโอนิวคลีโอไทด์ 3H-ไทมิดีนที่เพิ่มขึ้นเมื่อเทียบกับอาหารเลี้ยงเชื้ออื่นๆ
วิตามินซีมีความจำเป็นต่อการกระตุ้นเอนไซม์ที่เกี่ยวข้องกับการสร้างโครงสร้างเกลียวของเส้นใยคอลลาเจนที่เสถียร เซลล์กระดูกอ่อนที่ขาดกรดแอสคอร์บิกจะสังเคราะห์คอลลาเจนพรีเคอร์เซอร์ที่ไม่ใช่เกลียวที่มีไฮดรอกซิเลตไม่เพียงพอ ซึ่งจะถูกหลั่งออกมาอย่างช้าๆ การให้กรดแอสคอร์บิก (50 μg/ml) ทำให้เกิดไฮดรอกซิเลชันของคอลลาเจนประเภท II และ IX และการหลั่งของคอลลาเจนในปริมาณปกติ การเพิ่มวิตามินซีไม่ส่งผลต่อระดับการสังเคราะห์โปรตีโอไกลแคน ดังนั้น การหลั่งคอลลาเจนจึงได้รับการควบคุมอย่างอิสระจากการหลั่งโปรตีโอไกลแคน

