ผู้เชี่ยวชาญทางการแพทย์ของบทความ
สิ่งตีพิมพ์ใหม่
การตีบซ้ำ
Last reviewed: 04.07.2025

เนื้อหา iLive ทั้งหมดได้รับการตรวจสอบทางการแพทย์หรือตรวจสอบข้อเท็จจริงเพื่อให้แน่ใจว่ามีความถูกต้องตามจริงมากที่สุดเท่าที่จะเป็นไปได้
เรามีแนวทางการจัดหาที่เข้มงวดและมีการเชื่อมโยงไปยังเว็บไซต์สื่อที่มีชื่อเสียงสถาบันการวิจัยทางวิชาการและเมื่อใดก็ตามที่เป็นไปได้ โปรดทราบว่าตัวเลขในวงเล็บ ([1], [2], ฯลฯ ) เป็นลิงก์ที่คลิกได้เพื่อการศึกษาเหล่านี้
หากคุณรู้สึกว่าเนื้อหาใด ๆ ของเราไม่ถูกต้องล้าสมัยหรือมีข้อสงสัยอื่น ๆ โปรดเลือกแล้วกด Ctrl + Enter
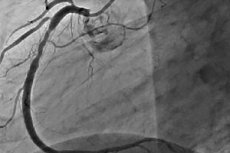
ภาวะตีบซ้ำคือภาวะที่หลอดเลือดหัวใจตีบซ้ำมากกว่าร้อยละ 50 ขึ้นไปที่ตำแหน่งที่เจาะหลอดเลือดหัวใจผ่านผิวหนัง ภาวะตีบซ้ำมักมาพร้อมกับอาการเจ็บหน้าอกซ้ำ ซึ่งมักต้องเจาะซ้ำหลายครั้ง เมื่อ PCI พัฒนาขึ้น อุบัติการณ์ของภาวะตีบซ้ำก็ลดลง และลักษณะของโรคก็เปลี่ยนไปด้วย
การตีบซ้ำหลังการทำบอลลูนขยายหลอดเลือดหัวใจผ่านช่องท้อง (TBCA)
หลังจาก TBCA อัตราการเกิดซ้ำของหลอดเลือดใน 6 เดือนแรกอยู่ที่ 30-40% กลไกหลักในการพัฒนาคือการปรับเปลี่ยนหลอดเลือดในเชิงลบในพื้นที่ ซึ่งโดยพื้นฐานแล้วคือการยุบตัวแบบยืดหยุ่นของลูเมนของหลอดเลือดแดง ซึ่งขยายตัวโดยบอลลูนในระหว่างขั้นตอน การก่อตัวของลิ่มเลือดในพื้นที่และการเติบโตของนีโออินทิมาก็มีบทบาทที่เกี่ยวข้องเช่นกัน มีปัจจัยเสี่ยงทางคลินิก (เบาหวานชนิดที่ 2, กลุ่มอาการหลอดเลือดหัวใจเฉียบพลัน (ACS), ประวัติการเกิดซ้ำของหลอดเลือด), การตรวจหลอดเลือด (รอยโรค LAD, หลอดเลือดมีขนาดเส้นผ่านศูนย์กลางเล็ก, การอุดตันทั้งหมดเรื้อรัง (CTO), รอยโรคยาว, การปลูกถ่ายหลอดเลือดดำที่เสื่อมสภาพ) และขั้นตอนทางหัตถการ (การตีบที่เหลือขนาดใหญ่, เส้นผ่านศูนย์กลางหลอดเลือดเพิ่มขึ้นเล็กน้อยอันเป็นผลจากการพองบอลลูน) สำหรับการเกิดซ้ำของ TBCA ในกรณีของการเกิดซ้ำของหลอดเลือด มักจะทำการแทรกแซงซ้ำ ความสำเร็จของ TBCA ซ้ำที่บริเวณที่เกิดการซ้ำของหลอดเลือดนั้นเทียบได้กับขั้นตอนแรก อย่างไรก็ตาม ในแต่ละครั้งที่ TBCA เกิดขึ้นซ้ำ ความเสี่ยงของการเกิดซ้ำของ TBCA จะเพิ่มขึ้นอย่างมีนัยสำคัญ หลังจากความพยายามครั้งที่ 3 ความเสี่ยงจะเพิ่มขึ้นเป็น 50-53% นอกจากนี้ ในแต่ละครั้งที่ TBCA เกิดขึ้นซ้ำ การเกิดซ้ำของ TBCA ที่เกิดขึ้นจะเด่นชัดกว่าครั้งแรก ปัจจัยเสี่ยงของการเกิดซ้ำของ TBCA หลังจาก TBCA ครั้งที่สอง ได้แก่ การปรากฏของการเกิดซ้ำของ TBCA ครั้งแรกในระยะเริ่มต้น (60-90 วันหลังจากขั้นตอน) ความเสียหายของ LAD ความเสียหายของหลอดเลือดหลายเส้น เบาหวานประเภท 2 ความดันโลหิตสูง โรคหลอดเลือดหัวใจตีบที่ไม่เสถียร และการพองตัวของบอลลูนหลายครั้งในระหว่างขั้นตอนแรก เมื่อพิจารณาจากความถี่ของการเกิดซ้ำของ TBCA ที่สูงและกลไกการพัฒนาของภาวะดังกล่าว จึงได้มีการนำสเตนต์หลอดเลือดหัวใจมาใช้ในทางคลินิก ซึ่งในทางทฤษฎีแล้วควรจะช่วยขจัดการเปลี่ยนแปลงของหลอดเลือดเชิงลบหลังจาก TBCA ได้
การศึกษาครั้งแรกที่แสดงให้เห็นถึงประสิทธิภาพของการใส่ขดลวดคือการศึกษา STRESS และ BENESTENT ที่ตีพิมพ์ในปี 1993 BENESTENT รวมผู้ป่วย 516 รายที่เพิ่งได้รับการวินิจฉัยว่าเป็นโรคตีบในหลอดเลือดหัวใจที่มีเส้นผ่านศูนย์กลางมากกว่า 3 มม. ซึ่งถูกสุ่มเป็นสองกลุ่ม ได้แก่ TBCA แบบธรรมดา (n = 257) และ TBCA ที่ใส่ขดลวด (n = 259) หลังจาก 3 ปี อัตราการตีบซ้ำระหว่างการตรวจหลอดเลือดคือ 32% ในกลุ่ม TBCA แบบธรรมดา และ 22% ในกลุ่มที่ใส่ขดลวด อัตราการลดลงสัมพันธ์กันของอัตราการตีบซ้ำคือ 31% (p < 0.01) กลุ่มที่ใส่ขดลวดยังมีความต้องการการสร้างหลอดเลือดใหม่ให้กับกล้ามเนื้อหัวใจซ้ำน้อยกว่า (10 เทียบกับ 20.6% ในกลุ่ม TBCA แบบธรรมดา; p < 0.01) ซึ่งเกี่ยวข้องกับอัตราการเกิดโรคหลอดเลือดหัวใจตีบซ้ำที่ต่ำกว่าในกลุ่มที่ใส่ขดลวด
จากการศึกษา STRESS (n = 407) พบว่าอัตราการเกิดการตีบซ้ำในกลุ่มที่ใส่สเตนต์ (n ~ 205) ต่ำกว่าในกลุ่มที่ใส่ PTCA แบบดั้งเดิม (n = 202) คือ 31.6 เทียบกับ 42.1% (p < 0.01) ข้อดีของการใช้สเตนต์เมื่อเทียบกับการทำบอลลูนขยายหลอดเลือดแบบธรรมดาในกรณีที่เกิดการตีบซ้ำที่บริเวณ PTCA ได้รับการพิสูจน์แล้วจากการศึกษา REST ซึ่งผู้ป่วย 383 รายที่เป็นโรคตีบซ้ำได้รับการสุ่มให้ใส่สเตนต์หรือทำบอลลูนขยายหลอดเลือดหัวใจแบบผ่านผิวหนังซ้ำ การตรวจพบการเกิดการตีบซ้ำโดยการตรวจหลอดเลือดลดลง 18% ในกลุ่มที่ใส่สเตนต์ (18 เทียบกับ 5.32%; p < 0.03) การสร้างหลอดเลือดใหม่ในกล้ามเนื้อหัวใจซ้ำๆ ซึ่งเป็นตัวบ่งชี้การเกิดซ้ำของหลอดเลือดตีบอย่างมีนัยสำคัญทางคลินิก ยังมีความจำเป็นน้อยกว่าอย่างมีนัยสำคัญในกลุ่มผู้ป่วยที่ได้รับการใส่ขดลวด (10 เทียบกับ 27%; p < 0.001) ดังนั้น ผลลัพธ์ที่ดีขึ้นจากการใช้ขดลวดจึงได้รับการพิสูจน์แล้ว ไม่เพียงแต่ในหลอดเลือดแดงดั้งเดิมเท่านั้น แต่ยังรวมถึงกรณีการแทรกแซงสำหรับการเกิดซ้ำของหลอดเลือดที่เกิดขึ้นหลังจาก TBCA ด้วย
การตีบซ้ำหลังการใส่สเตนต์เปล่า (BSI)
แม้ว่าการใส่สเตนต์หลอดเลือดหัวใจโดยไม่ปิดบังจะช่วยลดอุบัติการณ์การเกิดซ้ำของหลอดเลือดหัวใจได้ 30-40% เมื่อเทียบกับ TBCA แต่ผู้ป่วย 17-32% เกิดการซ้ำของหลอดเลือดหัวใจในสเตนต์แม้หลังจากการใส่สเตนต์แล้ว ซึ่งจำเป็นต้องสร้างหลอดเลือดใหม่อีกครั้ง กลไกการเกิดการตีบในสเตนต์ (ISS) แตกต่างจาก TBCA หลังจากการใส่สเตนต์แล้ว ปัจจัยหลักที่ทำให้เกิดการซ้ำของหลอดเลือดหัวใจคือการก่อตัวของนีโออินทิมา มากกว่าการปรับเปลี่ยนเชิงลบ เช่นใน TBCA ซึ่งแทบจะไม่มีเลยที่บริเวณที่ใส่สเตนต์ นีโออินทิมาเกิดขึ้นจากการอพยพและการขยายตัวของเซลล์กล้ามเนื้อเรียบซึ่งสร้างเมทริกซ์นอกเซลล์ ซึ่งจะประกอบเป็นนีโออินทิมาร่วมกับเซลล์ นอกจากนี้ การคงอยู่ของลิ่มเลือดที่บริเวณที่ใส่สเตนต์ยังมีความสำคัญในผู้ป่วยโรคเบาหวานอีกด้วย
การจำแนกประเภทหลักของภาวะตีบในสเตนต์ (ISS) คือประเภทที่เมห์รานเสนอ ซึ่งประกอบด้วย 4 ประเภทขึ้นอยู่กับขอบเขตและความรุนแรงของรอยโรค ได้แก่ ประเภท I ISS - เฉพาะที่ (ยาว < 10 มม.), ประเภท II - แพร่กระจาย (> 10 มม. ยาว), ประเภท III - แพร่กระจาย (> 10 มม. และขยายออกไปเกินสเตนต์) และประเภท IV - ISS นำไปสู่การอุดตัน ประเภทแรกแบ่งออกเป็นประเภทย่อยตามตำแหน่งในสเตนต์ ได้แก่ 1a - บนโค้งหรือระหว่างสเตนต์, 1b - ขอบ, 1c - ภายในสเตนต์, 1d - หลายจุด
ปัจจัยเสี่ยงต่อการเกิด VRS ได้แก่ การผ่าตัดบายพาสหลอดเลือดดำ การอุดตันเรื้อรัง รอยโรคที่ช่องเปิดหลอดเลือดขนาดเล็ก การมีหลอดเลือดตีบที่เหลืออยู่ การใส่สเตนต์สำหรับ VRS หลอดเลือดหลังทำหัตถการขนาดเล็ก รอยโรค LAD ความยาวของสเตนต์ที่ยาว การมีโรคเบาหวาน การใส่สเตนต์หลายอันในรอยโรคเดียว มีข้อบ่งชี้ถึงอิทธิพลของปัจจัยทางพันธุกรรม โดยเฉพาะอย่างยิ่งความหลากหลายทางพันธุกรรมของยีนไกลโคโปรตีน IIIa และการกลายพันธุ์ของยีนเมทิลีนเทตระไฮโดรโฟเลตรีดักเตส ซึ่งเป็นยีนที่เข้ารหัสอินเตอร์ลิวคิน-1 ในกรณีที่เกิดการตีบซ้ำของสเตนต์ที่ขอบ ปัจจัยเสี่ยงหลักคือรอยโรคหลอดเลือดแดงแข็งที่เด่นชัดในส่วนที่ใส่สเตนต์
ภาวะตีบซ้ำเกิดขึ้นส่วนใหญ่ในช่วง 6-8 เดือนแรกหลังจากการแทรกแซงหลอดเลือดหัวใจผ่านผิวหนัง ผู้ป่วยส่วนใหญ่มีอาการทางคลินิกในช่วงเวลาเดียวกัน VRS มักแสดงอาการด้วยอาการเจ็บหน้าอกซ้ำๆ อาการเจ็บหน้าอกไม่คงที่เกิดขึ้นน้อยกว่า (11-41% ของผู้ป่วย) ภาวะกล้ามเนื้อหัวใจตายเฉียบพลันเกิดขึ้นในผู้ป่วย 1-6% ดังนั้น สาเหตุที่พบบ่อยที่สุดของภาวะตีบในช่วง 1-6 เดือนหลังการใส่ขดลวดคือการเกิด VRS ซึ่งโดยทั่วไปต้องสร้างหลอดเลือดใหม่ซ้ำๆ มีวิธีการรักษา VRS หลายวิธี สามารถทำ TBCA แบบเดิมได้ ซึ่งจะส่งผลให้ขดลวดขยายตัวมากขึ้น (56% ส่งผลให้เส้นผ่านศูนย์กลางของหลอดเลือดเพิ่มขึ้นในที่สุด) และดันนีโออินติมาผ่านเซลล์ของขดลวด (44% ส่งผลให้เส้นผ่านศูนย์กลางเพิ่มขึ้นในที่สุด) อย่างไรก็ตาม ในกรณีส่วนใหญ่ ภาวะตีบซ้ำจะเกิดขึ้นที่บริเวณที่แทรกแซง (โดยเฉลี่ย 18%) นอกจากนี้ หลังจาก TBCA จำเป็นต้องสร้างหลอดเลือดใหม่อีกครั้งใน 11% ของกรณี โดยส่วนใหญ่มักอยู่ในผู้ป่วยที่มีโรคหลอดเลือดหลายเส้นที่มี LVEF ต่ำ ในกรณีของการแทรกแซงในการปลูกถ่ายหลอดเลือดดำบายพาสหรือการเกิด VRS ครั้งแรกในระยะเริ่มต้น ความเสี่ยงในการเกิด VRS ซ้ำหลังจาก TBCA ยังขึ้นอยู่กับประเภทของรอยโรคด้วย โดยอยู่ในช่วง 10% ในกรณีของการตีบซ้ำเฉพาะที่ ไปจนถึง 80% ในกรณีของการอุดตันภายในสเตนต์ การใส่ LES ไว้ที่ตำแหน่งของ VRS ไม่ได้ช่วยลดความเสี่ยงของการเกิดซ้ำเมื่อเปรียบเทียบกับ TBCA เพียงอย่างเดียว
วิธีการรักษา VRS วิธีที่สองคือ การบำบัดภายในหลอดเลือด ซึ่งเกี่ยวข้องกับการนำแหล่งกำเนิดรังสีเข้าไปในช่องว่างของหลอดเลือดหัวใจ เพื่อป้องกันการแบ่งตัวของเซลล์กล้ามเนื้อเรียบ และลดความเสี่ยงของการเกิดภาวะตีบซ้ำ อย่างไรก็ตาม ค่าใช้จ่ายด้านอุปกรณ์ที่สูง ความซับซ้อนทางเทคนิคของขั้นตอนการรักษา และอุบัติการณ์ของภาวะลิ่มเลือดอุดตันจากสเตนต์ในระยะหลัง (LT) ที่เพิ่มมากขึ้น ทำให้การบำบัดภายในหลอดเลือดไม่สามารถนำไปใช้ทางคลินิกได้เกือบทั้งหมด
การนำสเตนต์เคลือบยามาใช้ถือเป็นช่วงเวลาแห่งการปฏิวัติในการรักษา VRS เมื่อเปรียบเทียบกับ LES ในหลอดเลือดแดงดั้งเดิม สเตนต์เหล่านี้สามารถลดความเสี่ยงของ VRS ได้ถึง 70-80% ข้อมูลแรกเกี่ยวกับประสิทธิภาพของ DES ในผู้ป่วยที่มี VRS อยู่แล้วนั้นได้มาจากทะเบียนผู้ป่วย TAXUS III ซึ่งเมื่อใช้ SPG1 ในผู้ป่วยดังกล่าว ความถี่ของการเกิดซ้ำของ VRS จะอยู่ที่เพียง 16% หลังจาก 6 เดือน ซึ่งต่ำกว่าในการศึกษาที่กล่าวถึงก่อนหน้านี้ที่ใช้ TBCA ในทะเบียน TRUE ซึ่งรวมถึงผู้ป่วยหลังการใส่ SES สำหรับโรคตีบซ้ำของ LES หลังจาก 9 เดือน จำเป็นต้องสร้างหลอดเลือดใหม่ซ้ำในผู้ป่วยน้อยกว่า 5% โดยส่วนใหญ่เป็นโรคเบาหวานและ ACS การศึกษา TROPICAL ได้เปรียบเทียบความถี่ของการเกิดซ้ำของการเกิดซ้ำในผู้ป่วยหลังการใส่ DES ที่บริเวณที่เกิดการตีบซ้ำกับข้อมูลของการศึกษา GAMMA I และ GAMMA II ซึ่งใช้การบำบัดด้วยรังสีภายในเป็นวิธีการรักษา หลังจากผ่านไป 6 เดือน อุบัติการณ์ของการเกิดซ้ำของหลอดเลือดตีบซ้ำนั้นต่ำกว่าอย่างมีนัยสำคัญในกลุ่ม SPS (9.7 เทียบกับ 40.3%; p < 0.0001) สิ่งสำคัญที่ต้องทราบคือ อุบัติการณ์ของการเกิดลิ่มเลือดจากสเตนต์และกล้ามเนื้อหัวใจตายก็ต่ำกว่าในกลุ่ม SPS เช่นกัน (TS 0.6 เทียบกับ 3.9%; p = 0.08; MI - 1.8 เทียบกับ 9.4%; p = 0.004) ข้อได้เปรียบของ SPS เมื่อเทียบกับการบำบัดด้วยรังสีภายในได้รับการยืนยันในการศึกษาวิจัย SISR แบบสุ่ม ซึ่งผู้ป่วย 384 รายที่มีภาวะ VRS ที่เกิดขึ้นใน NSC ได้รับการสุ่มให้เข้ากลุ่มบำบัดด้วยรังสีภายในหรือกลุ่มฝัง SPS หลังจากผ่านไป 9 เดือน ความจำเป็นในการสร้างหลอดเลือดซ้ำนั้นสูงกว่าหลังการบำบัดด้วยรังสีภายใน (19.2%) เมื่อเทียบกับกลุ่มฝัง SPS (8.5%) ซึ่งสะท้อนให้เห็นการเกิดซ้ำของภาวะหลอดเลือดตีบซ้ำบ่อยกว่า หลังจาก 3 ปี ข้อได้เปรียบของ SPS ในแง่ของการลดความจำเป็นในการสร้างหลอดเลือดใหม่เนื่องจากการเกิดหลอดเลือดตีบซ้ำของสเตนต์ยังคงอยู่ (19 เทียบกับ 28.4%) ไม่มีความแตกต่างอย่างมีนัยสำคัญในอุบัติการณ์ของการเกิดลิ่มเลือดระหว่างกลุ่ม
ปัจจัยหลักที่ทำให้เกิด VRS ซ้ำในผู้ป่วย LES ในกรณีการปลูกถ่าย SPS คือ เส้นผ่านศูนย์กลางหลอดเลือดเล็ก (< 2.5 มม.) การเกิดซ้ำแบบกระจาย และภาวะไตวายเรื้อรังที่ต้องฟอกไต ในการศึกษาแบบสุ่ม TAXUS V ISR พบว่า SPS มีประสิทธิภาพสูงในการรักษา VRS โดยลดอัตราการเกิดซ้ำแบบซ้ำได้ 54% เมื่อเทียบกับการบำบัดด้วยรังสีภายใน
นอกจากนี้ ยังมีการทดลองแบบสุ่มที่เปรียบเทียบประสิทธิภาพของ TBCA สำหรับการใส่ VRS และ DES ในการทดลองแบบสุ่ม RIBS-II หลังจาก 9 เดือน การเกิดซ้ำของหลอดเลือดตีบเกิดขึ้นน้อยกว่า 72% หลังจากใส่ DES เมื่อเทียบกับ TBCA ซึ่งช่วยลดความจำเป็นในการสร้างหลอดเลือดซ้ำจาก 30% เป็น 11% การทดลอง ISAR DESIRE เปรียบเทียบประสิทธิภาพของ TBCA สำหรับ VRS กับการใส่ SPP หรือ SPS หลังจาก 6 เดือน พบว่า DES ทั้งสองแบบมีประสิทธิภาพในการป้องกันการซ้ำของหลอดเลือดตีบมากกว่า TBCA (อุบัติการณ์อยู่ที่ 44.6% ในกลุ่ม TBCA, 14.3% ในกลุ่ม SPS และ 21.7% ในกลุ่ม SPS) ซึ่งช่วยลดความจำเป็นในการสร้างหลอดเลือดซ้ำ ในการเปรียบเทียบโดยตรงระหว่าง SPP และ SPS พบว่า SPS ลดความจำเป็นในการสร้างหลอดเลือดซ้ำได้อย่างมีประสิทธิภาพมากกว่า SPP อย่างมีนัยสำคัญ (8 เทียบกับ 19%) ดังนั้น การฝัง DES จะลดการเกิด LES VRS ซ้ำเมื่อเปรียบเทียบกับ TBCA และการบำบัดด้วยรังสีภายใน ซึ่งจะช่วยลดจำนวนการทำ PCI ซ้ำ และทำให้การฝัง DES เป็นขั้นตอนที่ผู้ป่วยเลือกทำ
การตีบซ้ำหลังการใส่สเตนต์เคลือบยา (DES)
แม้ว่าอุบัติการณ์ของการเกิดตีบในหลอดเลือดจะลดลง 70-80% เมื่อใช้ DES เมื่อเทียบกับ LES แต่ก็ไม่สามารถตัดความเป็นไปได้ของการเกิดผลที่ตามมาจากการใส่ขดลวดที่เกิดจากแพทย์ได้ทั้งหมด อุบัติการณ์โดยรวมของ DES ยังคงน้อยกว่า 10% นอกจากการลดลงเชิงปริมาณของอุบัติการณ์ของการเกิดตีบซ้ำแล้ว พวกเขายังเปลี่ยนแปลงประเภทของการเกิดตีบซ้ำที่เกิดขึ้นอย่างมีนัยสำคัญ ดังนั้น หลังจากการใส่ DES การเกิดตีบซ้ำมักจะเกิดขึ้นเฉพาะที่ ในทางคลินิก เช่นเดียวกับในกรณีของ LES มักแสดงอาการเป็นอาการกำเริบของโรคหลอดเลือดหัวใจตีบแบบคงที่ (77%) น้อยกว่า (8%) ที่ไม่มีอาการ ใน 5% ของกรณี แสดงอาการเป็นอาการหลอดเลือดหัวใจตีบแบบไม่คงที่ และใน 10% อาการแรกคือกล้ามเนื้อหัวใจตายแบบไม่ใช่คลื่น Q ปัจจัยหลักในการเกิดตีบซ้ำจาก DES คือ เบาหวานชนิดที่ 2 เส้นผ่านศูนย์กลางของหลอดเลือดขนาดเล็ก และขอบเขตของรอยโรค ไม่มีคำแนะนำที่ชัดเจนสำหรับการจัดการผู้ป่วยดังกล่าว ทางเลือกอื่นๆ ได้แก่ การฝัง DES ซ้ำ (ชนิดเดียวกันหรือชนิดอื่น) TBCA หรือการบำบัดด้วยรังสีภายใน อัตราการกลับมาตีบซ้ำโดยเฉลี่ยด้วย DES ครั้งที่สองอยู่ที่ 24% และจะเท่ากันไม่ว่าจะฝัง DES ชนิดเดียวกันหรือชนิดอื่นก็ตาม


 [
[