กลไกทางพันธุกรรมใหม่อาจให้เป้าหมายในการรักษาโรคเนื้องอกไกลโอมา
ตรวจสอบล่าสุด: 14.06.2024

เนื้อหา iLive ทั้งหมดได้รับการตรวจสอบทางการแพทย์หรือตรวจสอบข้อเท็จจริงเพื่อให้แน่ใจว่ามีความถูกต้องตามจริงมากที่สุดเท่าที่จะเป็นไปได้
เรามีแนวทางการจัดหาที่เข้มงวดและมีการเชื่อมโยงไปยังเว็บไซต์สื่อที่มีชื่อเสียงสถาบันการวิจัยทางวิชาการและเมื่อใดก็ตามที่เป็นไปได้ โปรดทราบว่าตัวเลขในวงเล็บ ([1], [2], ฯลฯ ) เป็นลิงก์ที่คลิกได้เพื่อการศึกษาเหล่านี้
หากคุณรู้สึกว่าเนื้อหาใด ๆ ของเราไม่ถูกต้องล้าสมัยหรือมีข้อสงสัยอื่น ๆ โปรดเลือกแล้วกด Ctrl + Enter
การวิจัยจากห้องปฏิบัติการของ Shi-Yuan Cheng, PhD ศาสตราจารย์ในแผนกประสาทวิทยา Ken and Ruth Davey ของ Neuro-Oncology ในแผนกประสาทวิทยา ได้ระบุกลไกใหม่ที่เป็นพื้นฐานของเหตุการณ์การตัดต่อ RNA ทางเลือกในเซลล์เนื้องอกในสมองซึ่งอาจทำหน้าที่เป็นเป้าหมายการรักษาใหม่ ผลการศึกษานี้ตีพิมพ์ในวารสาร Journal of Clinical Investigation
“เราพบวิธีการรักษา Gliomas แบบอื่นโดยใช้เทคนิคการตัดต่อแบบทางเลือก และค้นพบเป้าหมายใหม่ที่ไม่เคยระบุมาก่อน แต่มีความสำคัญต่อมะเร็งของก้อนเนื้อในสมอง” ดร. Xiao Song ผู้ช่วยศาสตราจารย์ด้านประสาทวิทยาและหัวหน้าคณะผู้จัดทำการศึกษากล่าว
ก้อนเนื้อในสมองเป็นเนื้องอกในสมองที่พบบ่อยที่สุดในผู้ใหญ่ มีต้นกำเนิดมาจากเซลล์เกลีย ซึ่งพบได้ในระบบประสาทส่วนกลางและทำหน้าที่สนับสนุนเซลล์ประสาทบริเวณใกล้เคียง เนื้องอกในสมองมีความต้านทานต่อการรักษาแบบมาตรฐานสูง รวมถึงการฉายรังสีและเคมีบำบัด เนื่องจากเนื้องอกมีลักษณะทางพันธุกรรมและเอพิเจเนติกที่ไม่เหมือนกัน ซึ่งเน้นย้ำถึงความจำเป็นในการค้นหาเป้าหมายการรักษาใหม่ๆ
การศึกษาครั้งก่อนๆ ของห้องปฏิบัติการ Cheng ซึ่งตีพิมพ์ใน Cancer Research แสดงให้เห็นว่าปัจจัยการตัดต่อที่สำคัญ SRSF3 นั้นเพิ่มขึ้นอย่างมีนัยสำคัญในเนื้องอกในสมองเมื่อเทียบกับสมองปกติ และการตัดต่อ RNA ที่ควบคุมโดย SRSF3 จะส่งเสริมการเติบโตและการดำเนินไปของเนื้องอกในสมองโดยมีอิทธิพลต่อกระบวนการต่างๆ ในเซลล์หลายเซลล์ในเซลล์เนื้องอก
การตัดต่อ RNA เป็นกระบวนการที่เกี่ยวข้องกับการกำจัดอินทรอน (ส่วนที่ไม่เข้ารหัสของ RNA) และการเชื่อมต่อของเอ็กซอน (ส่วนที่เข้ารหัส) เพื่อสร้างโมเลกุล mRNA ที่โตเต็มที่ซึ่งสนับสนุนการแสดงออกของยีนในเซลล์
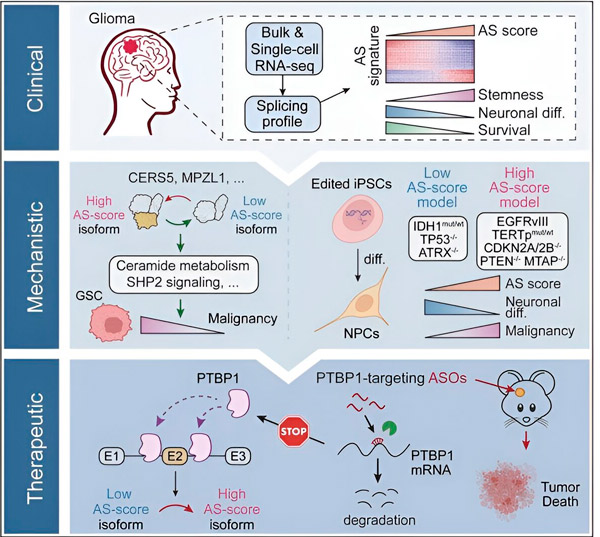
ในการศึกษานี้ นักวิทยาศาสตร์ มุ่งมั่นที่จะระบุการเปลี่ยนแปลงในการตัดต่อทางเลือกในเซลล์เนื้องอกกาวเนื้อสมอง กลไกที่อยู่เบื้องหลังการเปลี่ยนแปลงเหล่านี้ และพิจารณาศักยภาพของการเปลี่ยนแปลงเหล่านี้ในฐานะเป้าหมายการรักษา
นักวิจัยใช้กระบวนการคำนวณและเทคโนโลยีการจัดลำดับ RNA เพื่อศึกษาการเปลี่ยนแปลงในการตัดต่อในเซลล์เนื้องอกกาวเนื้อสมองจากตัวอย่างผู้ป่วย เพื่อยืนยันการเปลี่ยนแปลงเหล่านี้ พวกเขาใช้เทคโนโลยีการตัดต่อยีน CRISPR เพื่อนำการกลายพันธุ์ของตัวขับเคลื่อนของก้อนเนื้อในสมองที่แตกต่างกันเข้าสู่โมเดลก้อนเนื้อในสมองที่ได้จากเซลล์ต้นกำเนิดพหุศักยภาพของมนุษย์ (iPSC)
พวกเขาพบว่าการเปลี่ยนแปลงของการตัดต่อนี้ได้รับการปรับปรุงโดยตัวรับปัจจัยการเจริญเติบโตของเอพิเดอร์มัล III (EGFRIII) ซึ่งเป็นที่ทราบกันว่ามีการแสดงออกมากเกินไปในเนื้องอกหลายชนิด รวมถึงก้อนเนื้อในสมอง และถูกยับยั้งโดยการกลายพันธุ์ในยีน IDH1
นักวิจัยยืนยันหน้าที่ของเหตุการณ์การตัดต่อ RNA สองเหตุการณ์ที่สร้างไอโซฟอร์มโปรตีนที่แตกต่างกันที่มีลำดับกรดอะมิโนที่แตกต่างกัน
"มีเพียงไอโซฟอร์มเดียวเท่านั้นที่สามารถส่งเสริมการเติบโตของเนื้องอก ซึ่งแตกต่างจากไอโซฟอร์มอีกแบบหนึ่ง ซึ่งปกติแล้วจะแสดงออกในสมองปกติ เนื้องอกใช้กลไกนี้เพื่อแสดงไอโซฟอร์มที่ส่งเสริมเนื้องอกอย่างเลือกสรรเหนือไอโซฟอร์มสมองปกติ" ซองกล่าว
จากนั้นทีมงานได้วิเคราะห์การจับกับ RNA ต้นน้ำ โปรตีนและพบว่ายีน PTBP1 ควบคุมการตัดต่อ RNA ที่ส่งเสริมเนื้องอกในเซลล์กาวเนื้อสมอง โดยใช้แบบจำลองเมาส์ที่มีภูมิคุ้มกันบกพร่องแบบออร์โธโทปิกของกาวเนื้อสมอง นักวิจัยกำหนดเป้าหมาย PTBP1 ด้วยการบำบัดด้วยโอลิโกนิวคลีโอไทด์แบบแอนติเซนส์ (ASO) ซึ่งสุดท้ายแล้วสามารถยับยั้งการเติบโตของเนื้องอกได้
"ข้อมูลของเราเน้นย้ำถึงบทบาทของการประกบ RNA ทางเลือกในการมีอิทธิพลต่อมะเร็งเนื้องอกและความหลากหลายของเนื้องอก และศักยภาพของมะเร็งชนิดนี้ในฐานะที่เป็นช่องโหว่ในการรักษาสำหรับการรักษาเนื้องอกเนื้องอกในผู้ใหญ่" ผู้เขียนการศึกษาเขียนไว้
นักวิจัยวางแผนที่จะสำรวจศักยภาพของการกำหนดเป้าหมาย PTBP1 ต่อไปเพื่อกระตุ้นการตอบสนองของระบบภูมิคุ้มกันต้านมะเร็ง Song กล่าว
"ด้วยการใช้การวิเคราะห์ RNA-seq ที่อ่านมานาน เราค้นพบว่าการกำหนดเป้าหมาย PTBP1 ในเซลล์ glioma ส่งผลให้เกิดการผลิตสำเนาที่เชื่อมต่อแบบอื่นซึ่งไม่มีอยู่ในเนื้อเยื่อปกติ ดังนั้น โครงการต่อไปของเราคือการค้นหาว่าไอโซฟอร์มนี้สามารถ สร้างแอนติเจนบางส่วน" เพื่อให้ระบบภูมิคุ้มกันสามารถจดจำเนื้องอกได้ดีขึ้น" ซ่งกล่าว
ซองยังเสริมอีกว่าทีมงานของเธอสนใจที่จะวิเคราะห์การเปลี่ยนแปลงการประกบของเซลล์ที่ไม่ใช่เนื้องอกจากผู้ป่วยเนื้องอกไกลโอมา เช่น เซลล์ภูมิคุ้มกัน
"เรารู้อยู่แล้วว่าการประกบมีความสำคัญมากในการควบคุมการทำงานของเซลล์ ดังนั้นจึงไม่ควรควบคุมเฉพาะเนื้อร้ายของเนื้องอกเท่านั้น แต่ยังสามารถควบคุมการทำงานของเซลล์ภูมิคุ้มกันเพื่อตรวจสอบว่าพวกมันสามารถฆ่ามะเร็งได้อย่างมีประสิทธิภาพหรือไม่ ดังนั้นเราจึงยัง ทำการวิเคราะห์ทางชีวสารสนเทศศาสตร์ในเซลล์ภูมิคุ้มกันที่แทรกซึมเข้าไปในเนื้องอก เพื่อดูว่ามีการเปลี่ยนแปลงในการต่อรอยหรือไม่ หลังจากที่เซลล์ภูมิคุ้มกันแทรกซึมเข้าไปในเนื้องอกแล้ว
“เป้าหมายของเราคือการกำหนดบทบาทของการต่อรอยทางเลือกอื่นในการสร้างสภาพแวดล้อมจุลภาคของเนื้องอกที่กดภูมิคุ้มกัน และระบุเป้าหมายที่เป็นไปได้ในการปรับปรุงประสิทธิผลของการบำบัดด้วยภูมิคุ้มกันในเนื้องอกไกลโอมา” Song กล่าว
