สิ่งตีพิมพ์ใหม่
อุปกรณ์ใหม่ช่วยปรับปรุงการสร้างเซลล์ต้นกำเนิดเพื่อใช้ในการบำบัดโรคอัลไซเมอร์
ตรวจสอบล่าสุด: 02.07.2025

เนื้อหา iLive ทั้งหมดได้รับการตรวจสอบทางการแพทย์หรือตรวจสอบข้อเท็จจริงเพื่อให้แน่ใจว่ามีความถูกต้องตามจริงมากที่สุดเท่าที่จะเป็นไปได้
เรามีแนวทางการจัดหาที่เข้มงวดและมีการเชื่อมโยงไปยังเว็บไซต์สื่อที่มีชื่อเสียงสถาบันการวิจัยทางวิชาการและเมื่อใดก็ตามที่เป็นไปได้ โปรดทราบว่าตัวเลขในวงเล็บ ([1], [2], ฯลฯ ) เป็นลิงก์ที่คลิกได้เพื่อการศึกษาเหล่านี้
หากคุณรู้สึกว่าเนื้อหาใด ๆ ของเราไม่ถูกต้องล้าสมัยหรือมีข้อสงสัยอื่น ๆ โปรดเลือกแล้วกด Ctrl + Enter

นักวิจัยในสวีเดนกล่าวว่าพวกเขาได้พัฒนาเทคนิคในการแปลงเซลล์ผิวหนังธรรมดาให้เป็นเซลล์ต้นกำเนิดของระบบประสาทได้อย่างสมบูรณ์แบบ ซึ่งพวกเขาบอกว่าจะทำให้ใกล้เคียงกับการบำบัดเซลล์แบบเฉพาะบุคคลราคาไม่แพงสำหรับโรค อัลไซเมอร์และพาร์กินสันมากขึ้น
ทีมวิจัยได้พัฒนาวิธีการที่ไม่เคยมีมาก่อนและรวดเร็วในการรีโปรแกรมเซลล์ผิวหนังของมนุษย์ให้เป็นเซลล์ต้นกำเนิดพหุศักยภาพที่เหนี่ยวนำ (induced pluripotent stem cells หรือ iPSCs) จากนั้นแปลงเซลล์เหล่านี้ให้เป็นเซลล์ต้นกำเนิดของระบบประสาท โดยใช้เครื่องมือไมโครฟลูอิดิกที่ออกแบบเฉพาะบุคคล
Saumya Jain ผู้เขียนคนแรกของการศึกษากล่าวว่าแพลตฟอร์มดังกล่าวสามารถปรับปรุงและลดต้นทุนการบำบัดด้วยเซลล์ได้โดยทำให้เซลล์เข้ากันได้และร่างกายของผู้ป่วยยอมรับได้มากขึ้น การศึกษานี้ได้รับการตีพิมพ์ในวารสาร Advanced Scienceโดยนักวิทยาศาสตร์จาก KTH Royal Institute of Technology
แอนนา เฮอร์แลนด์ ผู้เขียนอาวุโสของการศึกษากล่าวว่า การศึกษานี้แสดงให้เห็นการใช้ไมโครฟลูอิดิกส์เป็นครั้งแรกเพื่อควบคุมให้ iPSC กลายมาเป็นเซลล์ต้นกำเนิดของระบบประสาท
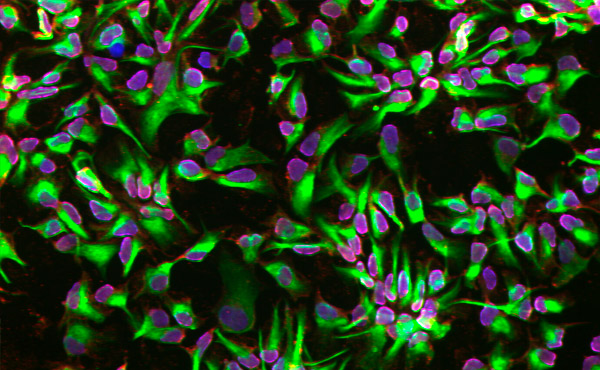
เซลล์ต้นกำเนิดของระบบประสาทแยกความแตกต่างโดยใช้แพลตฟอร์มไมโครฟลูอิดิก ภาพถ่าย: KTH Royal Institute of Technology
การเปลี่ยนเซลล์ปกติให้กลายเป็นเซลล์ต้นกำเนิดของระบบประสาทนั้นจริงๆ แล้วเป็นกระบวนการ 2 ขั้นตอน ขั้นตอนแรกคือเซลล์จะได้รับสัญญาณทางชีวเคมีที่กระตุ้นให้เซลล์กลายเป็นเซลล์ต้นกำเนิดพหุศักยภาพ (pluripotent stem cells หรือ iPSC) ซึ่งสามารถสร้างเซลล์ได้หลายประเภท
จากนั้นเซลล์เหล่านี้จะถูกถ่ายโอนไปยังวัฒนธรรมที่เลียนแบบสัญญาณและกระบวนการพัฒนาที่เกี่ยวข้องกับการสร้างระบบประสาท ขั้นตอนนี้เรียกว่าการแบ่งเซลล์ประสาท ซึ่งจะเปลี่ยนเส้นทางเซลล์ไปสู่การเป็นเซลล์ต้นกำเนิดของระบบประสาท
ในช่วงทศวรรษที่ผ่านมา สภาพแวดล้อมของห้องปฏิบัติการสำหรับงานประเภทนี้ค่อยๆ เปลี่ยนจากแท็บเล็ตแบบดั้งเดิมไปเป็นอุปกรณ์ไมโครฟลูอิดิกส์ Herland กล่าวว่าแพลตฟอร์มใหม่นี้ถือเป็นการพัฒนาไมโครฟลูอิดิกส์ในทั้งสองขั้นตอน ได้แก่ การสร้าง iPSC และการแยกความแตกต่างของเซลล์ต้นกำเนิดของระบบประสาท
นักวิจัยใช้เซลล์จากชิ้นเนื้อผิวหนังของมนุษย์เพื่อพบว่าแพลตฟอร์มไมโครฟลูอิดิกส์ช่วยเร่งการมุ่งมั่นของเซลล์ต่อชะตากรรมของระบบประสาทในระยะเริ่มต้นได้เร็วกว่าเซลล์ที่แยกความแตกต่างในจานธรรมดา
“เราได้บันทึกไว้ว่าสภาพแวดล้อมที่จำกัดของแพลตฟอร์มไมโครฟลูอิดิกช่วยเพิ่มความมุ่งมั่นในการสร้างเซลล์ต้นกำเนิดของระบบประสาท” Herland กล่าว
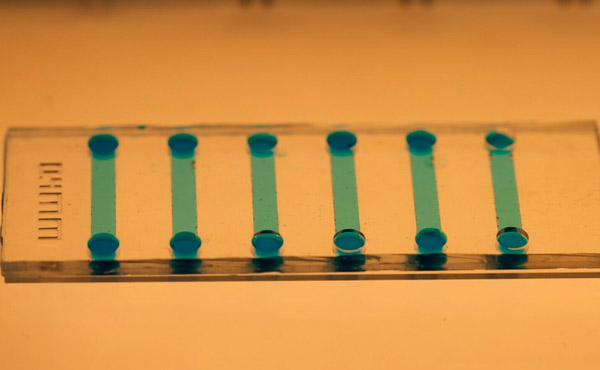
ภาพระยะใกล้ของชิปไมโครฟลูอิดิกที่ใช้เหนี่ยวนำเซลล์ต้นกำเนิด ภาพโดย: KTH Royal Institute of Technology
Jain กล่าวว่าชิปไมโครฟลูอิดิกนั้นสามารถผลิตได้ง่ายโดยใช้โพลีไดเมทิลซิโลเซน (PDMS) และขนาดเล็กมากยังทำให้ประหยัดปริมาณสารเคมีและวัสดุเซลล์ได้อย่างมาก
เขาเสริมว่าแพลตฟอร์มนี้สามารถปรับเปลี่ยนได้อย่างง่ายดายเพื่อรองรับการแยกตัวเป็นเซลล์ประเภทอื่น ๆ นอกจากนี้ยังสามารถทำงานอัตโนมัติได้ โดยให้ระบบปิดที่รับประกันความสม่ำเสมอและความน่าเชื่อถือในการผลิตประชากรเซลล์ที่มีความเป็นเนื้อเดียวกันสูง
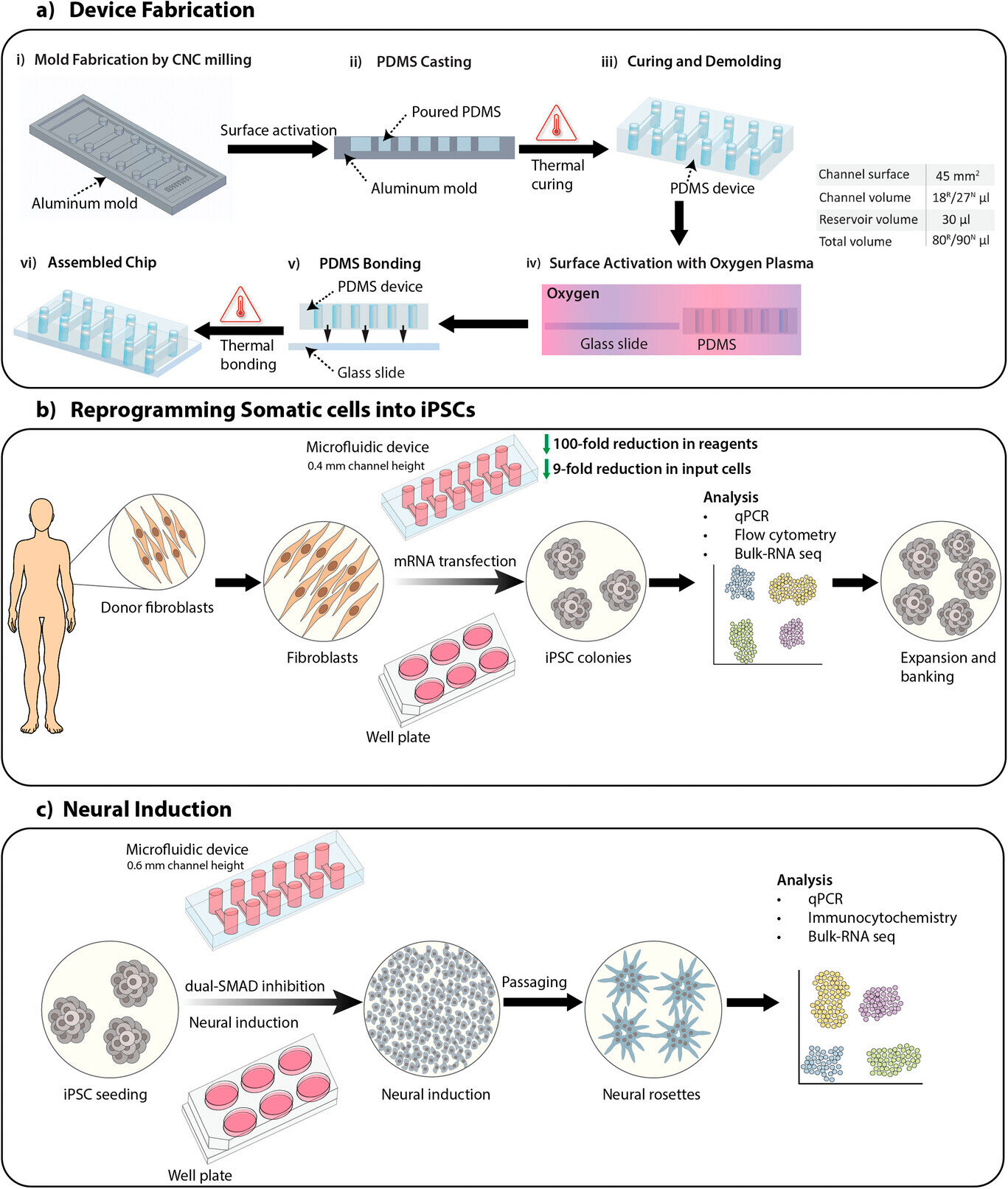
ภาพรวมของการศึกษานี้รวมถึงการผลิตอุปกรณ์ การเขียนโปรแกรมใหม่ของเซลล์ร่างกายเป็นเซลล์ต้นกำเนิดพหุศักยภาพที่เหนี่ยวนำ (iPSC) และการเหนี่ยวนำ iPSC ทางประสาทโดยใช้โปรโตคอลการยับยั้งคู่ SMAD เพื่อสร้างเซลล์ต้นกำเนิดของระบบประสาท
A) กระบวนการผลิตอุปกรณ์ไมโครฟลูอิดิกที่มีช่องสูง 0.4 มม. และ 0.6 มม. สำหรับการรีโปรแกรมเซลล์ร่างกาย (R) และการเหนี่ยวนำทางประสาท (N) ตามลำดับ ปริมาตรของช่องและปริมาตรทั้งหมดแสดงอยู่ในตาราง
B) ภาพรวมของกระบวนการรีโปรแกรมเซลล์ร่างกายเป็น iPSC บนอุปกรณ์ไมโครฟลูอิดิกและเพลตโดยใช้การถ่ายโอน mRNA
C) ภาพรวมของกระบวนการเหนี่ยวนำ iPSC ทางประสาทในเซลล์ต้นกำเนิดของระบบประสาทบนอุปกรณ์ไมโครฟลูอิดิกและเพลตโดยใช้โปรโตคอลการยับยั้งคู่ SMAD
แหล่งที่มา: Advanced Science (2024) DOI: 10.1002/advs.202401859
“ถือเป็นก้าวสำคัญในการทำให้การบำบัดด้วยเซลล์แบบเฉพาะบุคคลสำหรับโรคอัลไซเมอร์และพาร์กินสันสามารถเข้าถึงได้” Jain กล่าวเสริม
การศึกษาครั้งนี้ยังเกี่ยวข้องกับนักวิทยาศาสตร์จากสถาบัน Karolinska และมหาวิทยาลัย Lund ที่ร่วมมือกันในกลุ่ม IndiCell
