สิ่งตีพิมพ์ใหม่
TIVDAK® ที่ได้รับการอนุมัติจาก FDA: กำหนดเป้าหมายปัจจัยเนื้อเยื่อในมะเร็งปากมดลูก
ตรวจสอบล่าสุด: 02.07.2025

เนื้อหา iLive ทั้งหมดได้รับการตรวจสอบทางการแพทย์หรือตรวจสอบข้อเท็จจริงเพื่อให้แน่ใจว่ามีความถูกต้องตามจริงมากที่สุดเท่าที่จะเป็นไปได้
เรามีแนวทางการจัดหาที่เข้มงวดและมีการเชื่อมโยงไปยังเว็บไซต์สื่อที่มีชื่อเสียงสถาบันการวิจัยทางวิชาการและเมื่อใดก็ตามที่เป็นไปได้ โปรดทราบว่าตัวเลขในวงเล็บ ([1], [2], ฯลฯ ) เป็นลิงก์ที่คลิกได้เพื่อการศึกษาเหล่านี้
หากคุณรู้สึกว่าเนื้อหาใด ๆ ของเราไม่ถูกต้องล้าสมัยหรือมีข้อสงสัยอื่น ๆ โปรดเลือกแล้วกด Ctrl + Enter
เมื่อวันที่ 29 เมษายน 2024 สำนักงานคณะกรรมการอาหารและยาของสหรัฐอเมริกา (FDA) ได้อนุมัติให้ TIVDAK® (tisotumab vedotin) ของบริษัท Seagen Inc. ได้รับการรับรองอย่างสมบูรณ์ ซึ่งเป็นยาที่กำหนดเป้าหมายที่ปัจจัยเนื้อเยื่อ (TF) สำหรับการรักษาผู้ป่วยมะเร็งปากมดลูก ที่กลับมาเป็นซ้ำหรือแพร่กระจาย ซึ่งลุกลามระหว่างหรือหลังการทำเคมีบำบัดถือเป็นความก้าวหน้าครั้งสำคัญในการรักษามะเร็งปากมดลูก โดยเน้นย้ำถึงศักยภาพของแอนติบอดีคอนจูเกตยา (ADC) ในสาขาเนื้องอกวิทยา
กลไกการออกฤทธิ์ของ TIVDAK
Tivdak คือ ADC ที่กำหนดเป้าหมายที่ TF โดยการผสานแอนติบอดีโมโนโคลนอลต่อต้าน TF ของ Genmab อย่าง tisotumab เข้ากับเทคโนโลยี ADC ของ Seagen ที่ออกแบบมาเพื่อกำหนดเป้าหมายแอนติเจน TF บนเซลล์มะเร็งและส่งส่วนประกอบ MMAE ที่เป็นพิษต่อเซลล์โดยตรงไปยังเซลล์มะเร็ง
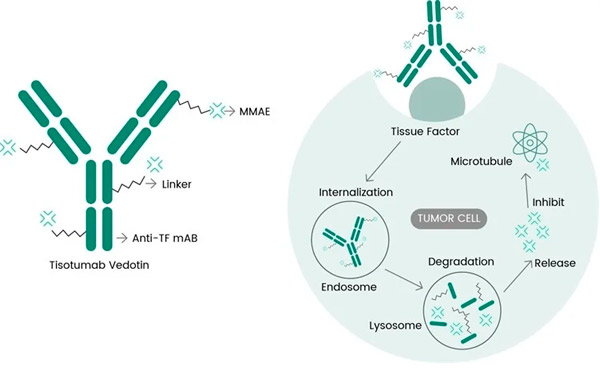
กลไกการออกฤทธิ์ในระดับโมเลกุลของ tisotumab vedotin ( https://doi.org/10.3390/ijms23073559 )
TF: เป้าหมายที่สมบูรณ์แบบสำหรับการพัฒนา ADC
เป็นที่ทราบกันดีว่า TF มีส่วนเกี่ยวข้องกับการส่งสัญญาณของเนื้องอกและการสร้างหลอดเลือดใหม่ และมีการแสดงออกมากเกินไปในผู้ป่วยมะเร็งปากมดลูกและเนื้องอกแข็งอื่นๆ จำนวนมาก ความสามารถในการถูกดูดซึมเข้าสู่เซลล์อย่างรวดเร็วเมื่อแอนติบอดีจับกับเซลล์ และมีผลกระทบน้อยที่สุดต่อการแข็งตัวของเลือดปกติ ทำให้ TF เหมาะสมกับการบำบัดมะเร็งแบบกำหนดเป้าหมายมากยิ่งขึ้น
