ชี้แจงกลไกของเซลล์ของโรคปริทันต์อักเสบด้วยแบบจำลองสัตว์ที่ได้รับการปรับปรุง
ตรวจสอบล่าสุด: 14.06.2024

เนื้อหา iLive ทั้งหมดได้รับการตรวจสอบทางการแพทย์หรือตรวจสอบข้อเท็จจริงเพื่อให้แน่ใจว่ามีความถูกต้องตามจริงมากที่สุดเท่าที่จะเป็นไปได้
เรามีแนวทางการจัดหาที่เข้มงวดและมีการเชื่อมโยงไปยังเว็บไซต์สื่อที่มีชื่อเสียงสถาบันการวิจัยทางวิชาการและเมื่อใดก็ตามที่เป็นไปได้ โปรดทราบว่าตัวเลขในวงเล็บ ([1], [2], ฯลฯ ) เป็นลิงก์ที่คลิกได้เพื่อการศึกษาเหล่านี้
หากคุณรู้สึกว่าเนื้อหาใด ๆ ของเราไม่ถูกต้องล้าสมัยหรือมีข้อสงสัยอื่น ๆ โปรดเลือกแล้วกด Ctrl + Enter
นักวิจัยจากมหาวิทยาลัยการแพทย์และทันตกรรมแห่งโตเกียว (TMDU) ได้พัฒนาเทคนิคที่ช่วยให้พวกเขาสามารถวิเคราะห์รายละเอียดเกี่ยวกับการพัฒนาของโรคปริทันต์อักเสบเมื่อเวลาผ่านไป
โรคปริทันต์ซึ่งแสดงโดย โรคปริทันต์อักเสบ เป็นสาเหตุหลักของการสูญเสียฟันและส่งผลกระทบต่อผู้ใหญ่เกือบหนึ่งในห้าทั่วโลก ในกรณีส่วนใหญ่ ภาวะนี้เกิดขึ้นจากการตอบสนองต่อการอักเสบต่อการติดเชื้อแบคทีเรียของเนื้อเยื่อรอบฟัน
เมื่ออาการแย่ลง เหงือกจะเริ่มร่น เผยให้เห็นรากของฟันและกระดูก โดยเฉพาะอย่างยิ่ง อุบัติการณ์ของโรคปริทันต์อักเสบจะเพิ่มขึ้นตามอายุ และเนื่องจากประชากรทั่วโลกมีอายุขัยเฉลี่ยเพิ่มขึ้น การมีความเข้าใจอย่างมั่นคงเกี่ยวกับสาเหตุและการลุกลามของโรคปริทันต์จึงเป็นสิ่งสำคัญ
ในการศึกษาที่ตีพิมพ์ใน Nature Communications นักวิจัย TMDU พบวิธีที่จะบรรลุเป้าหมายนี้โดยการปรับปรุงแบบจำลองสัตว์ที่ใช้กันอย่างแพร่หลายในการศึกษาโรคปริทันต์อักเสบ
การศึกษาโดยตรงเกี่ยวกับโรคปริทันต์อักเสบในมนุษย์เป็นเรื่องยาก ด้วยเหตุนี้ นักวิทยาศาสตร์จึงมักหันไปใช้แบบจำลองสัตว์เพื่อการวิจัยพรีคลินิก ตัวอย่างเช่น "แบบจำลองโรคปริทันต์อักเสบที่เกิดจาก ligation ในหนู" นับตั้งแต่เปิดตัวในปี 2012 ช่วยให้นักวิจัยสามารถศึกษากลไกของเซลล์ที่เป็นสาเหตุของภาวะนี้ได้
พูดง่ายๆ ก็คือ ในแบบจำลองนี้ โรคปริทันต์เกิดขึ้นได้โดยการเย็บไหมบนฟันกรามของหนู ซึ่งทำให้เกิดการสะสมของคราบพลัค แม้ว่าวิธีนี้จะสะดวกและมีประสิทธิภาพ แต่ก็ไม่ได้ครอบคลุมภาพรวมของโรคปริทันต์อักเสบ
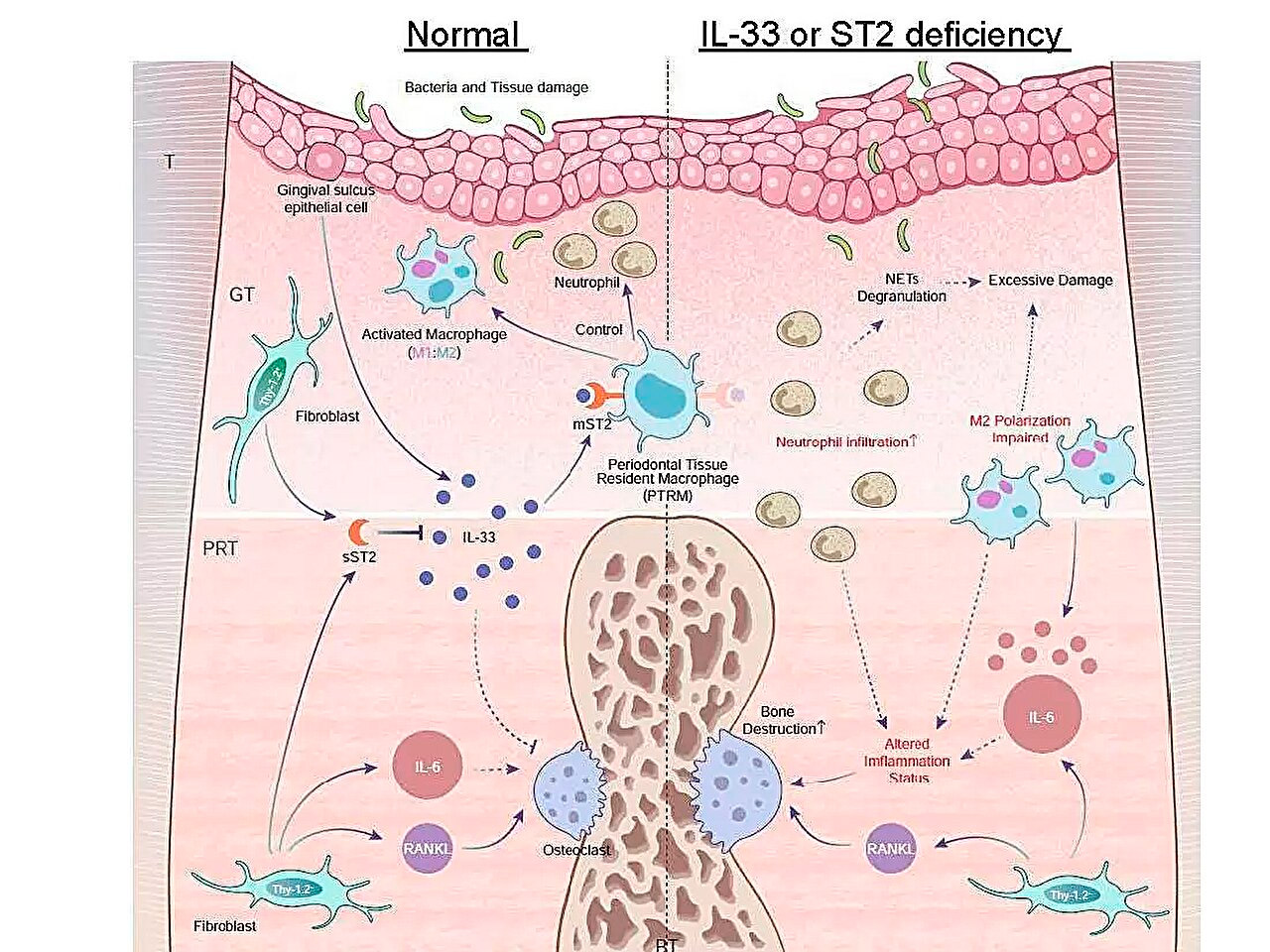
ภาพประกอบแผนผังโปรไฟล์การแสดงออกของยีนอักเสบระหว่างโรคปริทันต์อักเสบ และบทบาทของแกน IL-33/ST2 ในการควบคุมการอักเสบเฉียบพลัน ที่มา: มหาวิทยาลัยการแพทย์และทันตกรรมแห่งโตเกียว
"แม้ว่าเนื้อเยื่อปริทันต์จะประกอบด้วยเหงือก เอ็นปริทันต์ กระดูกถุงลม และซีเมนต์ แต่การวิเคราะห์มักจะดำเนินการเฉพาะกับตัวอย่างเหงือกเท่านั้น เนื่องจากข้อจำกัดทางเทคนิคและเชิงปริมาณ" Anhao Liu ผู้เขียนรายงานการศึกษากล่าว "กลยุทธ์การสุ่มตัวอย่างนี้จำกัดข้อสรุปที่ได้จากการศึกษาเหล่านี้ ดังนั้นจึงจำเป็นต้องมีวิธีการที่สามารถวิเคราะห์ส่วนประกอบของเนื้อเยื่อทั้งหมดได้พร้อมกัน"
เพื่อแก้ไขข้อจำกัดนี้ ทีมวิจัยได้พัฒนาแบบจำลองที่ได้รับการแก้ไขของโรคปริทันต์อักเสบที่เกิดจากการผูกมัด แทนที่จะใช้มัดเดี่ยวแบบคลาสสิก พวกเขาใช้มัดสามที่ฟันกรามซ้ายบนของหนูตัวผู้ กลยุทธ์นี้ขยายพื้นที่ของการสูญเสียมวลกระดูกโดยไม่ทำลายกระดูกอย่างมีนัยสำคัญรอบฟันกรามที่ 2 ทำให้เนื้อเยื่อปริทันต์ประเภทต่างๆ มีจำนวนเพิ่มขึ้น
"เราแยกเนื้อเยื่อหลักสามประเภทและประเมินผลผลิต RNA ระหว่างทั้งสองแบบจำลอง ผลลัพธ์แสดงให้เห็นว่าแบบจำลอง ligation แบบสามตัวเพิ่มผลผลิตได้อย่างมีประสิทธิภาพ โดยบรรลุปริมาณของเนื้อเยื่อรอบนอกปกติถึงสี่เท่า และรองรับการวิเคราะห์ที่มีความละเอียดสูงของเนื้อเยื่อประเภทต่างๆ," อธิบายโดยดร. มิกิฮิโตะ ฮายาชิ ซีเนียร์
หลังจากยืนยันประสิทธิผลของแบบจำลองที่ปรับเปลี่ยนแล้ว นักวิจัยได้เริ่มศึกษาผลของโรคปริทันต์อักเสบต่อการแสดงออกของยีนในเนื้อเยื่อประเภทต่างๆ เมื่อเวลาผ่านไป โดยมุ่งเน้นไปที่ยีนที่เกี่ยวข้องกับการอักเสบและความแตกต่างของเซลล์สร้างกระดูก
หนึ่งในการค้นพบหลักของพวกเขาคือการแสดงออกของยีน Il1rl1 สูงขึ้นอย่างมีนัยสำคัญในเนื้อเยื่อรอบขอบตาห้าวันหลังจากการผูกมัด ยีนนี้เข้ารหัสโปรตีน ST2 ในไอโซฟอร์มของตัวรับและตัวล่อ ซึ่งจับกับไซโตไคน์ที่เรียกว่า IL-33 ซึ่งเกี่ยวข้องกับกระบวนการอักเสบและการควบคุมภูมิคุ้มกัน
เพื่อให้ได้ข้อมูลเชิงลึกเพิ่มเติมเกี่ยวกับบทบาทของยีนนี้ ทีมงานได้กระตุ้นให้เกิดโรคปริทันต์อักเสบในหนูดัดแปลงพันธุกรรมที่ไม่มียีน Il1rl1 หรือ Il33 หนูเหล่านี้แสดงให้เห็นถึงการทำลายกระดูกด้วยการอักเสบแบบเร่ง โดยเน้นบทบาทในการป้องกันของวิถีทาง IL-33/ST2 การวิเคราะห์เพิ่มเติมของเซลล์ที่มีโปรตีน ST2 ในรูปแบบตัวรับ mST2 แสดงให้เห็นว่าส่วนใหญ่มาจากมาโครฟาจ
"โดยทั่วไปแล้วมาโครฟาจถูกจำแนกออกเป็นสองประเภทหลัก ได้แก่ การอักเสบและต้านการอักเสบ ขึ้นอยู่กับการเปิดใช้งาน เราพบว่าเซลล์ที่แสดง mST2 มีลักษณะเฉพาะตรงที่พวกมันแสดงเครื่องหมายบางตัวของมาโครฟาจทั้งสองประเภทพร้อมกัน" ความเห็น ผู้เขียนอาวุโส ดร. ทาคาโนริ อิวาตะ "เซลล์เหล่านี้มีอยู่ในเนื้อเยื่อรอบนอกก่อนที่จะเริ่มมีการอักเสบ ดังนั้นเราจึงเรียกเซลล์เหล่านี้ว่า 'เซลล์ปริทันต์ขนาดใหญ่'"
ผลลัพธ์ของการศึกษาครั้งนี้ร่วมกันแสดงให้เห็นถึงพลังของแบบจำลองสัตว์ดัดแปลงในการศึกษาโรคปริทันต์อักเสบในระดับที่มีรายละเอียดมากขึ้น ลงไปจนถึงระดับชีวโมเลกุล
"เราเสนอความเป็นไปได้ของวิถีทางโมเลกุลแบบใหม่ IL-33/ST2 ซึ่งควบคุมการอักเสบและการทำลายกระดูกในโรคปริทันต์ พร้อมด้วยมาโครฟาจจำเพาะในเนื้อเยื่อรอบนอกซึ่งเกี่ยวข้องอย่างลึกซึ้งกับโรคปริทันต์ ซึ่งหวังว่าจะนำไปสู่ เพื่อการพัฒนากลยุทธ์การรักษาและวิธีการป้องกันแบบใหม่" ดร. โทโมกิ นากาชิมะ ผู้เขียนอาวุโสสรุป
